Влияние температуры на скорость реакции
Зависимость скорости реакции от температуры определя-ется правилом Вант-Гоффа, согласно которому при повыше-нии температуры на каждые 10 градусов скорость большин-ства реакций увеличивается в 2-4 раза. Математически эта зависимость выражается соотношением
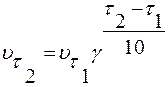
где: 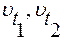 - скорости реакции соответственно при началом (t1) и конечной (t2) температурах;
- скорости реакции соответственно при началом (t1) и конечной (t2) температурах;
γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличится скорость реакции с повышением температуры реагирующих веществ на 10 градусов.
Дадим иную формулировку уравнения (1). Примем скорость реакции при начальной температуре (например, при 300°С) за 1 и будем выражать с помощью уравнения (1) скорость реакции  , определяя ее для разных температур (с интервалом в 10°). Тогда получим:
, определяя ее для разных температур (с интервалом в 10°). Тогда получим:

 t
t 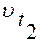
Арефметическая 300 20 = 1 Геометрическая
прогрессия 310 21 = 2 прогрессия
320 22 = 4
330 23 = 8
340 24 = 16…
400 210 = 1024
Из этого легко вывести следующее правило: при повышении температуры в арифметической прогрессии скорость реакции возрастает в геометрической прогрессии.
Температура влияет на скорость реакции, увеличивая константу скорости. Отношение, показывающее, во сколько раз увеличилась константа скорости при увеличении температуры на 10°, называется температурным коэффициентом скорости реакции, т.е.
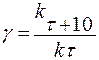
где: γ – температурный коэффициент скорости;
k t – константа скорости при температуре t;
kt+10 – константа скорости той же реакции при температуре t + 10°;
γ обычно изменяется от 2 до 4.
Зависимость скорости реакции от температуры более точно выражается уравнением Аррениуса
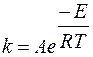
где: k – константа скорости;
A – постоянная, не зависящая от температуры;
e – основание натуральных логарифмов
(e=2,71828);
E – энергия активации (см. ниже);
R – газовая постоянная;
T – абсолютная температура.