Процессы
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ[2].

 8.1 Степень окисления элементов
8.1 Степень окисления элементов
В простых веществах химическая связь - ковалентная неполярная. В двухцентровой двухэлектронной связи связывающая электронная пара симметрична и сосредоточена посредине межатомного расстояния. Оба взаимодействующих атома проявляют ковалентность, равную сумме порядков всех связей данного атома с другими атомами молекулы. Взаимодействующие атомы не имеют эффективных зарядов, связь неполярна, электровалентности атомов равны нулю. Если химическая связь
образована двумя атомами с
близкими электроотрицатель-
ностями, то также образуется
ковалентная связь. Ковалентность
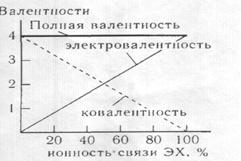
также равна порядку связи, относящемуся к той его доле, которая соответствует неполярной ковалентной связи. Однако часть электронной плотности химической связи в некоторой мере смещена к более электроотрицательному атому. На этом атоме появляется эффективный отрицательный заряд, а на менее электроотрицательном - эффективный, положительный заряд атома. Величина заряда есть электровалентность атома. Значит, при повышении полярности атома убывает, а электровалентность – возрастает. В предельном случае полярной связи ионной — связывающая электронная плотность полностью смещена к более электроотри-цательномуатому. Эффективные заряды на взаимодей-ствующих атомах приобретают мак симальные по модулю значения, а ковалентная составляющая связи отсутствует. Таким образом, в ионной связи ковалентность взаимодействующих атомов –равна нулю, а электрова-лентность достигает экстремальных значений (рис. 23).
Рис.23 построен на основании того, что ковалентность атома определяется неполярной составляющей химической связи, а электровалентность - эффективными зарядами атомов. Из рис.23 также видно, что, хотя ковалентность и электровалентности атомов изменяются различным образом, сумма ковалентности и модуля электровалентности, т. е. валентность атома остается постоянной.
Для уравнивания и определения вида возможных продуктов многих химических реакций существует специальный метод, основанный на понятии степени окисления. Для примера рассмотрим несколько соединений (табл. 20).
Изтаблицы 20 видно, что по мере увеличения ионности связи уменьшается доля ковалентности атома и увеличивается доля электровалентности атома при постоянстве его общей валентности. В последнем столбце табл. 20 приведены значения валентности атома со знаком его электровалентности. Соответствующая величина называется степенью окисления.