Гидролиз солей
Растворение вещества в воде часто сопровождается химическим взаимодействием. Взаимодействие вещества с водой, протекающее с образованием малодиссоциированного соединения, называется гидролизом. Поскольку при этом ионы соли взаимодействуют с ионами Н+ или ОН- воды, гидролиз сопровождается изменением рН раствора. Это происходит, когда равновесие диссоциации воды смещается в результате получения малодиссоциирующих электролитов или ионов. Гидролизу подвержены соединения различных классов, мы будем рассматривать гидролиз солей. Все соли можно разделить на четыре типа:
1) соли, образованные катионом сильного основания и сильной кислоты (NaCl, K2SO4, Ca(NO3)2 и др.);
2) соли, образованные катионом сильного основания и слабой кислоты (Na2CO3, K2S, CH3COONa и др.);
3) соли, образованные катионом слабого основания и сильной кислоты (NH4Cl, CuSO4, ZnCl2 и др.);
4) соли, образованные катионом слабого основания и слабой кислоты ((NH4)2S, Mg(CN)2, CH3COONH4 и др.).
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, реакция нейтрализации в этом случае сводится к процессу нейтрализации: Н+ + ОН - = Н2О, а обратная реакция – диссоциация воды на ионы протекает в ничтожно малой степени. В реакции гидролиза вступают соли второго, третьего и четвертого типов.
Рассмотрим гидролиз соли, образованной сильным основанием и слабой кислотой, например, ацетата натрия. Этот процесс можно представить в виде химического уравнения в молекулярной форме:
CH3COONa + H2O D CH3COOH + NaOH
или в ионно-молекулярной форме:
CH3COO - + H2O D CH3COOH + OH-.
Уравнение показывает, что в данном случае гидролизу подвергается анион соли и что реакция сопровождается образованием ионов гидроксила. Так как ионное произведение воды [H+] [OH-] величина постоянная, то при накоплении ионов ОН- концентрация ионов водорода уменьшается. Следовательно, растворы солей, образованных слабой кислотой и сильным основанием, имеют щелочную реакцию.
В случае соли, образованной слабым основанием и сильной кислотой, гидролизу подвергается катион соли и реакция сопровождается образованием ионов Н+, например:
NH4Cl + H2O D NH4OH + HCl
или
NH4+ + H2O D NH4OH + H+.
Накопление ионов Н+ приводит к уменьшению концентрации ионов ОН-, поэтому растворы солей, образованных сильной кислотой и слабым основанием, имеют кислую реакцию среды.
Гидролизу подвергается не все количество находящейся в растворе соли, а только часть его. При этом в растворе устанавливается равновесие между солью и образующими его кислотой и основанием. Доля вещества, подвергающаяся гидролизу, т.е. степень гидролиза, зависит от константы этого равновесия, а также от температуры и от концентрации соли.
Запишем уравнение гидролиза в общем виде, обозначая символом МеА кислоту, а МеОН – основание:
МеА + Н2О D НА + МеОН.
Этому равновесию соответствует константа:
 .
.
Концентрация воды в разбавленных растворах представляет собой постоянную величину. Обозначая К [H2O] = Kг, получим:
 .
.
Величина Кг называется константой гидролиза. Ее значение характеризует способность данной соли подвергаться гидролизу. Чем выше Кг, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз.
Для солей, образованных сильным основанием и слабой кислотой, Кг связана с константой диссоциации кислоты Ка зависимостью:
 .
.
Это уравнение показывает, что константа гидролиза Кг тем больше, чем меньше Ка. Иными словами, чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли.
Для солей, образованных слабым основанием и сильной кислотой, аналогичное соотношение связывает константу гидролиза с константой диссоциации основания Кв:
 .
.
Поэтому, чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза связана с константами диссоциации кислоты и основания следующим соотношением:
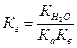 .
.
Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза. С разбавлением раствора и с увеличением температуры степень гидролиза увеличивается. Особенно глубоко протекает гидролиз солей, образованных слабой кислотой и слабым основанием. Реакция растворов солей в этом случае зависит от соотношения констант диссоциации кислоты и основания, образующих соль. Если константа диссоциации кислоты больше константы диссоциации основания, то раствор имеет слабокислую реакцию, при обратном соотношении констант диссоциации – слабощелочную.
Гидролиз солей многоосновных кислот или многокислотных оснований происходит по ступеням. Так, первая ступень гидролиза карбоната натрия протекает согласно уравнению:
Na2CO3 + H2O D NaHCO3 + NaOH
Или в ионно-молекулярной форме:
CO32- + H2O D HCO32- + OH-.
Образовавшаяся кислая соль в свою очередь подвергается гидролизу по второй ступени:
NaHCO3 + H2O D H2CO3 + NaOH
или
HCO3- + H2O D H2CO3 + OH-.
Как видно, при гидролизе по первой ступени образуется ион НСО3-, диссоциация которого характеризуется второй константой диссоциации угольной кислоты, а при гидролизе по второй ступени образуется угольная кислота, диссоциацию которой характеризует первая константа ее диссоциации. Поэтому константа гидролиза по первой ступени Кг,1 связана со второй константой диссоциации кислоты, а константа гидролиза по второй ступени Кг,2 – с первой константой диссоциации кислоты:


Так как первая константа диссоциации кислоты всегда больше второй, то константа гидролиза по первой ступени всегда больше, чем по второй.
Аналогично проходит гидролиз солей, образованных слабым основанием многовалентного металла. Например, гидролиз хлорида магния протекает по первой ступени с образованием хлорида гидроксомагния:
MgCl + H2O D MgOHCl + HCl.
Или в ионно-молекулярной форме:
Mg2+ + H2O D MgOH+ +H+.
Гидролиз по второй ступени происходит в ничтожно малой степени:
MgOHCl + H2O D Mg(OH)2 + HCl
MgOH+ + H2O D Mg(OH)2 + H+.
В аналитической практике гидролиз солей во многих случаях мешает выполнению аналитических реакций и его приходится подавлять. Например, при осаждении катионов Са2+, Sr2+ и Ва2+ карбонатом аммония (NH4)2СО3 прибавляют NH4OH для подавления гидролиза этого реагента:
(NH4)2СO3 + H2O D NH4HCO3 + NH4OH.
Соли, образованные некоторыми катионами и слабыми кислотами (например, H2S, H2СO3 и др.) гидролизуются в такой степени, что практически в водных растворах не существуют. Например, хотя большинство катионов осаждается сульфидом аммония (NH4)2S в виде сульфидов, ионы Cr3+ и Al3+ осаждаются в виде гидроксидов Cr(OH)3 и Al(OH)3. Это происходит потому, что концентрация гидроксид-ионов, образующихся при гидролизе (NH4)2S, достаточна, чтобы произведения растворимости Cr(OH)3 и Al(OH)3 были превышены и гидроксиды выпали в осадок. У других катионов этого не наблюдается, так как их гидроксиды более растворимы, чем сульфиды.
Если введение в раствор продуктов, образующихся при гидролизе, подавляет гидролиз, то связывание одного из продуктов в результате какой-нибудь реакции, наоборот, усиливает гидролиз.
Иногда ионы Al3+ и Fe3+ удаляют из раствора действием ацетата натрия CH3COONa. При этом в осадок выпадают не средние, а основные соли, также образующиеся в результате гидролиза:
Fe(CH3COO)3 + H2O D Fe(OH)(CH3COO)2 + CH3COOH
Fe(OH)(CH3COO)2 + H2O D Fe(OH)2(CH3COO) + CH3COOH.
Таким образом, не всегда гидролиз солей препятствует выполнению аналитических операций. Нередко его используют для обнаружения или отделения ионов.