рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Денисова С.А Химический анализ
Реферат Курсовая Конспект
Денисова С.А Химический анализ
Денисова С.А Химический анализ - раздел Химия, Ббк 24.4Я73 Д33 Удк 543.061/062(075.8) ...
ББК 24.4я73
Д33
УДК 543.061/062(075.8)
Денисова С.А.
ISBN 5-7944ВВЕДЕНИЕ
Химический анализ служит средством контроля производства и качества продукции во многих отраслях народного хозяйства – химической, нефтеперерабатывающей, в металлургии, горнодобывающей индустрии. На результатах анализа в значительной степени базируется разведка полезных ископаемых.
Научной основой химического анализа является аналитическая химия. В настоящее время эта наука в значительной степени изменилась: расширился арсенал методов анализа за счет появления новых более совершенных приборов; изменился подход к решению задач о формах существования компонентов в анализируемых пробах; появились новые возможности для повышения чувствительности и экспрессности анализа; расширился круг анализируемых объектов; значительно возросла роль аналитического контроля, особенно объектов окружающей среды. В связи с этим появились новые данные, которые порой изменяют устоявшиеся представления о механизме химических реакций, лежащих в основе тех или иных методов.
В учебно-методическом пособии кратко представлены теоретические основы аналитической химии, включая качественный и количественный анализ, с учетом современных тенденций, приведены методики выполнения лабораторных работ и образцы решения типовых задач. Для закрепления полученных знаний имеются вопросы для самоподготовки.
Освоение классических методов химического анализа, приобретение практических навыков при работе с химическим оборудованием, умелое выполнение химических реакций – вот основные задачи подготовки студентов на кафедре аналитической химии Пермского государственного университета. При изучении аналитической химии нужно научиться точно соблюдать последовательность методических рекомендаций, тщательно выполнять каждую операцию, связанную с определением качественного состава исследуемого объекта или его количественных характеристик. Очень существенно – воспитать в себе уважение к точности во всем, что касается эксперимента, к тщательности, даже к простой аккуратности. Данное пособие позволяет последовательно освоить основы аналитической химии.
ГЛАВА 1. ПРЕДМЕТ И ЗНАЧЕНИЕ АНАЛИТИЧЕСКОЙ ХИМИИ
Аналитическая химия – это наука, разрабатывающая теоретические основы и методы химического анализа. Это не просто дисциплина, накапливающая и систематизирующая знания; эта наука имеет огромное практическое значение в жизни общества, она создает средства для химического анализа и обеспечивает его осуществление – в этом ее главное предназначение.
Химический анализ – это важнейшее средство оценки качества разнообразной продукции, контроля технологических процессов, диагностики в медицине, главный инструмент контроля объектов окружающей среды. Без эффективного химического анализа невозможно функционирование ведущих отраслей народного хозяйства, систем охраны природы и здоровья населения, оборонного комплекса. На результатах химического анализа в значительной степени базируются выводы многих наук, например, молекулярной биологии, геохимии, химической кинетики. Химический анализ применяют для контроля качества сырья, полуфабрикатов и готовой продукции. Каждая отрасль науки и производства ставит перед аналитической химией свои специфические задачи и располагает своей прикладной аналитической службой. Объектами анализа могут быть природные продукты или промышленные материалы неорганического или органического происхождения, чистые соединения, металлы и сложные сплавы. Например, объектами технического анализа являются руды, металлы, техническое сырье; сельскохозяйственного – почвы, удобрения, корма; пищевого – продукты питания; санитарно-химического – воздух, почва, вода; фармацевтического - лекарственное сырье, лекарства. Полевые анализы полезных ископаемых дают геологу возможность оценить общие запасы элементов и сделать вывод об экономической целесообразности разработки месторождения.
Практической задачей аналитической химии является установление химического состава веществ или их смесей. В зависимости от цели анализа различают качественный и количественный анализ. Задачей качественного анализа является обнаружение компонентов анализируемого образца и идентификация соединений. Количественный анализ занимается определением количественных соотношений составных частей в веществе (их концентраций или масс).
По объему выполняемых исследований анализ может быть полным или частичным. Полный анализ позволяет определить качественный состав пробы, а затем количественное содержание каждого компонента. Такой анализ выполняют в геологических изысканиях (образцы руд, минералов, подземных вод), в металлургии. Частичный анализ дает возможность установить содержание в пробе одного или нескольких определенных компонентов, которые показывают качество образца. Например, о степени чистоты таблеток аспирина свидетельствует содержание в них примеси салициловой кислоты.
По периодичности отбора проб различают дискретный (анализ отдельных образцов) и непрерывный анализы. Дискретный анализ выполняют чаще всего в специальных лабораториях. Непрерывный анализ проводят непосредственно на производстве путем постоянного (без перерывов) измерения концентрации заданного компонента. Такой анализ необходим в тех случаях, когда изменение концентрации может существенно повлиять на проведение технологического процесса, качество производимого продукта или окружающую среду.
Все существующие методы аналитической химии можно разделить на методы пробоотбора, пробоподготовки (разложение пробы, разделение и концентрирование компонентов), обнаружения и определения. Существуют гибридные методы, сочетающие разделение и определение. Наибольшее значение имеют методы определения. Практически все они основаны на зависимости между составом вещества и его свойствами. Измеряемыми величинами могут служить масса, объем, поглощение света, электрический ток или потенциал электрода. Обычно измеряют свойство и по полученному сигналу судят о составе вещества, точнее о содержании интересующего компонента.
Методы аналитической химии могут быть классифицированы на основе различных принципов. Их можно подразделять в зависимости от массы вещества, взятой для анализа, от свойства вещества, которое положено в основу определения, от класса вещества, от целевой направленности анализа и т.д.
По характеру измеряемого свойства или по способу соответствующего сигнала методы определения делятся на химические, физические и биологические. Химические методы чаще всего основаны на взаимодействии вещества с веществом, точнее сказать, это методы, в основе которых лежат химические взаимодействия, химические реакции, в том числе электрохимические, ферментативные и даже, может быть иммунохимические. Иными словами, химические методы включают собственно химические, электрохимические и биохимические. Физические методы основаны на физических явлениях и процессах (взаимодействие вещества с потоком энергии). К физическим методам относят ядерно-физические, практически все спектроскопические. В биологических методах используют живые организмы или их фрагменты. Следует отметить, что эта классификация носит условный характер. Так, фотометрические методы, могут быть и химическими (в большинстве случаев), и чисто физическими. Это относится к люминесцентным методам. В ядерно-физических методах иногда важную роль играют химические операции; это особенно относится к радиохимическим методам.
В зависимости от того, какие именно компоненты нужно обнаружить или определить, выделяют изотопный, элементный, структурно-групповой (в том числе функциональный), молекулярный, вещественный и фазовый анализ.
По природе анализируемого объекта различают анализ неорганических и органических веществ, а также биологических объектов.
При классификации по свойству вещества метод анализа обычно сохраняет название измеряемого свойства. Если измеряется масса осадка, метод называется гравиметрическим, если определяется интенсивность окраски раствора, - фотометрическим, если ЭДС, - потенциометрическим и т.д.
При классификации по массе выделяют следующие методы: макрометод (0,1 г вещества и больше), полумикрометод (0,1-0,01 г), микрометод (0,01-10-3 г), ультрамикрометод (10-6 г) и субмикрометод (10-9). Методы, в которых используют 10-3 г и менее, применяют в анализе различных биологических проб, препаратов с высокой радиоактивностью, сильной токсичностью и т.д. Техника выполнения анализа в этих методах существенно усложняется: аналитические операции производят с помощью манипуляторов и нередко под микроскопом.
Существуют и другие классификации аналитических методов. Иногда имеют в виду определенные классы веществ: анализ металлов, анализ воды, газовый анализ, силикатный анализ, элементный анализ органических соединений и т.д.
Для современных методов аналитической химии характерно широкое использование оптических, электрических и других измерительных приборов, в том числе приборов автоматов (различных анализаторов, титрантов и т.д.) и регулирующей аппаратуры. Существенно возрастает также применение компьютеров и математических методов в химическом анализе.
Краткий очерк о развитии аналитической химии
Аналитическая химия прошла большой исторический путь. Можно выделить следующие периоды: наука древних; алхимия (IV-XVI вв.), ятрохимия (XVI-XVII… Анализ в древности. Неизвестно, когда люди стали изучать состав окружающих их… В произведениях Теофаста «О камнях» говорится об определении золота с помощью так называемого пробного, или пробирного…ГЛАВА 2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ АНАЛИТИЧЕСКОЙ ХИМИИ
Химическое равновесие в гомогенной системе. Закон действия масс.
Закон действия масс открыли в 1884 г. норвежские ученые К. Гульдберг и П. Вааге. Этот фундаментальный закон химии является теоретической основой… Реакции, используемые в аналитической химии, в большинстве случаев являются… Скоростью химической реакции () называют изменение концентрации реагирующих веществ в единицу времени. При этом…При установившемся равновесии отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ представляет собой для данной реакции при данной температуре величину постоянную, называемую константой равновесия. При этом концентрации каждого вещества должны быть возведены в степень, соответствующую их стехиометрическому коэффициенту.
Закон действия масс строго применим к неэлектролитам и слабым электролитам в разбавленных водных растворах. Концентрированные водные растворы слабых электролитов и все сильные электролиты (кислоты, щелочи, соли) дают существенные отклонения от закона действия масс.
При К = 1 скорости прямой и обратной реакции равны. Следовательно, изменение концентраций реагирующих веществ или их продуктов вызывает смещение равновесия химической реакции. Значение константы равновесия позволяет оценить направление и глубину протекания химической реакции. Если К > 1, это благоприятствует протеканию реакции в прямом направлении, если К < 1 – в обратном. При К = 1 скорости прямой и обратной реакции равны.
Следовательно, изменение концентраций реагирующих веществ или их продуктов вызывает смещение равновесия химической реакции. При увеличении концентраций A и B и уменьшении C и D равновесие сдвигается вправо, при увеличении концентраций C и D равновесие сдвигается влево.
Закон действия масс является частным случаем принципа Луи Ле-Шателье (1884 г), который утверждает, что каждое изменение факторов, определяющих химическое равновесие, вызывает процесс, сдвигающий это равновесие в направлении, ослабляющем эффект от произведенного изменения, или в современном виде: если химическая система подвергается воздействию, в ней возникают изменения, обеспечивающие противодействие этому воздействию.
Закон действия масс строго применим к неэлектролитам и слабым электролитам в разбавленных водных растворах. Слабые электролиты в концентрированных водных растворах и все сильные электролиты (кислоты, щелочи, соли) дают существенные отклонения от закона действия масс.
Протолитическая теория кислот и оснований
В 1923 г. Бренстед и Лоури предложили теорию кислот и оснований, получившую название протолитической. Теория основана на особенностях иона… Так как отдача протона кислотой является процессом обратимым, то получающийся… НА D А- + Н+Степень электролитической диссоциации
Большинство реакций, используемых в аналитической химии, проводится в растворах. Из курса общей химии известно, что многие химические вещества… Согласно теории электролитической диссоциации электролиты распадаются на… Процесс электролитической диссоциации изображают химическими уравнениями, например:Константа диссоциации слабого электролита
Процесс диссоциации молекул электролита является обратимым. В растворе устанавливается равновесие между ионами и недиссоциированными молекулами,… AB D A+ + B-; Если обозначить равновесную концентрацию недиссоциированных молекул [AB], а концентрации ионов соответственно [A+] и…Коэффициент активности и ионная сила
Для сильных электролитов констант диссоциации не существует, т.к. в растворах они обычно диссоциированы полностью. По этой причине число ионов в них… Для оценки состояния ионов в растворе пользуются величиной, называемой…Под активностью иона понимают ту эффективную, условную концентрацию его, соответственно которой он действует при химических реакциях.
а = f ∙ с, где f – коэффициент активности. Коэффициент активности характеризует влияние… Мерой взаимодействия между всеми ионами в растворе считается ионная сила раствора, которую обозначают символом µ.…Диссоциация воды. Водородный и гидроксильный показатели.
Реакции, применяемые в аналитической химии, протекают чаще всего в водных растворах. Вода является слабым электролитом, способным проводить… H2O + H2O D H3O+ + OH-. Упрощая, можно записать: H2O D H+ + OH-.Действие одноименных ионов. Буферные растворы.
Рассмотрим равновесие в растворе аммиака: NH3 + H2O D NH4+ + OH- Константу равновесия этой реакции можно представить уравнением:Гидролиз солей
Растворение вещества в воде часто сопровождается химическим взаимодействием. Взаимодействие вещества с водой, протекающее с образованием… 1) соли, образованные катионом сильного основания и сильной кислоты (NaCl,… 2) соли, образованные катионом сильного основания и слабой кислоты (Na2CO3, K2S, CH3COONa и др.);Произведение растворимости. Произведение активностей ионов
Химические взаимодействия, происходящие в растворах, могут сопровождаться образованием осадков, например: AgNO3 + HCl D AgCl↓ + HNO3 Насыщенный раствор и осадок отделены друг от друга поверхностью раздела и являются фазами гетерогенной (неоднородной)…Вопросы для самопроверки
1. В чем заключаются практические задачи аналитической химии? Какова роль аналитической химии в науке и производстве? 2. Назовите наиболее распространенные классификации методов анализа. 3. Что понимают под скоростью химической реакции и в каких единицах она измеряется?ГЛАВА 3. КАЧЕСТВЕННЫЙ АНАЛИЗ
Особенности аналитических реакций и способы их выполнения
Химические реакции, при проведении которых наблюдается аналитический эффект (сигнал), называются аналитическими химическими реакциями. Аналитическая… NH4Cl + NaOH = NH3↑ + H2O + NaCl. Селективные, или избирательные, реакции дают сходный эффект с несколькими ионами. Например, оксалат аммония образует…Лабораторное оборудование и техника выполнения качественного анализа
1) Пробирки цилиндрические – для выполнения реакций с отдельными порциями анализируемого раствора и для хранения жидкостей в ходе работы. 2) Пробирки конические (пробирки с суженным концом, «центрифужные») – для… 3) Фарфоровые чашки и тигли – для нагревания или выпаривания растворов, прокаливания сухих остатков, сплавления…Техника выполнения реакций
Микрокристаллоскопические реакции. Для обнаружения ионов можно использовать реакции, в результате которых образуются соединения с характерной формой… Каплю исследуемого раствора помещают на чистое и сухое предметное стекло,… Капельные реакции. Методика выполнения капельных реакций заключается в нанесении капель испытуемого раствора и…Методика выполнения основных операций в полумикроанализе
Нагреваниеи выпаривание.При проведении многих реакций требуется нагревание. Нагревать растворы в пробирках на открытом пламени горелки нельзя.… Выпаривание растворов для их концентрирования или упаривания досуха проводят в… Осаждение.Для получения осадка к нескольким каплям исследуемого раствора, обычно в центрифужной пробирке, прибавляют…Реакции обнаружения катионов
Таблица 1Кислотно-щелочная классификация катионов
| Номер группы | Катионы | Групповой реагент | Продукты реакции и аналитический сигнал |
| I | Ag+, Hg22+, Pb2+ | 2 M HCl | AgCl, Hg2Cl2, PbCl2. Осадки белого цвета |
| II | Ca2+, Ba2+, Sr2+ | 1 М H2SO4 | CaSO4, BaSO4. Осадки белого цвета, н.р. в кислотах и щелочах |
| III | Аl3+, Zn2+, Cr3+ Sn(II,IV), As(III,V) | Избыток 2 М NaOH+H2O2 | АlO2-, ZnO22-, AsO43-, SnO32- - бесцветные растворы; CrO42- – раствор желтого цвета |
| IV | Mg2+, Mn2+, Fe(II,III) | Избыток 2 М NaOH (KOH) + H2O2 | H2MnO3, Mg(OH)2, Fe(ОН)3. Mg(OH)2 - осадок белого цвета; H2MnO3, Fe(ОН)3 - осадки бурого цвета |
| V | Cu2+, Cd2+, Co2+, Ni2+ Hg2+ | Избыток раствора NH3 | [Cu(NH3)4]2+, [Cd(NH3)4]2+, [Ni(NH3)6]2+,[Co(NH3)6]3+, [Hg(NH3)4]2+ |
| VI | NH4+, Na+, K+ | Нет | Открывают дробным методом |
Первая группа катионов
Реакции ионов серебра
Реакция с хлороводородной кислотой и ее солями.
AgNO3 + НCl = AgCl↓ + NaNO3 . Хлорид серебра чернеет на свету вследствие разложения и выделения… Осадок AgCl растворяется в концентрированных HCl, NH4OH, Na2S2O3, KCN с образованием комплексных соединений. Например,…Реакция с гидроксидами щелочных металлов и аммиаком.
2AgNO3 + 2NaOH =Ag2O↓ + H2O + NaNO3; Ag2O + 4NH4OH = 2[Ag (NH3)2]ОН + 3H2O. Полученный комплекс не дает осадка с НNO3.Реакция с KI.
AgNO3 + KI =AgI↓ + KNO3; AgI + KI =K[AgI2]; AgI + Na2S2O3 = Na[AgS2O3] + NaI.Вторая группа катионов
Реакции ионов кальция
CaCl2 + (NH4)2C2O4- = CaC2O4↓ + 2NH4Cl. Осадок растворим в сильных кислотах, но нерастворим в СН3СООН даже при… Предел обнаружения кальция – 20 мкг.Реакции ионов бария
Реакции с серной кислотой и ее солями.
BaCl2 + H2SO4 = BaSO4↓ + 2HCl. Осадок нерастворим в кислотах и щелочах. Сульфаты кальция и стронция обладают некоторой растворимостью в воде, поэтому их насыщенные растворы в виде гипсовой и…Третья группа катионов
Реакции ионов хрома (III)
CrCl3 + 3NaOH = Cr(OH)3↓ + 3NaCl; Cr(OH)3 +NaOH = NaCrO2 + 2H2O; Cr(OH)3 + 3NaOH = Na3[Cr(OH)6].Окисление хрома(III) в кислой среде.
Cr2(SO4)3 + 2KMnO4 + 5Н2О = К2Cr2О7 + 2H2MnO3↓ + 3H2SO4. Из уравнения реакции видно, что продукт окисления в этом случае – не желтый… Выполнение реакции. В пробирку вносят 2-3 капли раствора соли Сr3+, 1 каплю 1М раствора H2SO4, 2-3 капли раствора…Четвертая группа катионов
Реакции ионов магния
1. Гидрофосфат натрияобразует с ионами магния в присутствии NH3 при рН 9 белый кристаллический осадок MgNH4PO4∙6Н2О: MgCl2 +NaHPO4 + NH3 = MgNH4PO4↓ + 2NaCl. При рН>10 могут образоваться Mg(OH)2 и Mg3(PO4)2. Рекомендуется к кислому анализируемому раствору прибавлять…Капельная реакция Тананаева.
5. Органический реагент 8-оксихинолин в аммиачной среде образует устойчивое комплексное соединение с катионами магния – оксихинолят магния (Кнест =…Реакции ионов железа(II)
1. Гексацианоферрат (III) калия (красная кровяная соль) образует с ионами железа (II) синий осадок, называемый "турнбулевой синью": 3FeCl2 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2↓ + 6KCl. "турнбулева синь"Реакции ионов железа(III)
4FeCl3 + 3K4[Fe(CN)6]4- = Fe4[Fe(CN)6]3↓ + 12KCl. При малых концентрациях Fe3+ раствор окрашивается в синий цвет. Осадок… Выполнение реакции. К 1-2 каплям слабокислого раствора, содержащего ионы Fe(III) и имеющего рН 1-3, добавляют 1-2…Пятая группа катионов
Реакции ионов меди
Cu(NO3)2 + 2NH4OH = (CuOH)2(NO3)2↓+ 2NH4NO3 (CuOH)2(NO3)2↓+ 6NH4OH + 2NH4NO3 = 2[Cu(NH3)4](NO3)2 + 8Н2O. Ион тетрамминмеди(II) разрушается под действием кислот, вследствие чего синяя окраска переходит в голубую. Предел…Шестая группа катионов
Поскольку большинство солей катионов VI группы хорошо растворимо в воде, то этим и объясняется отсутствие группового реактива. Кроме того, катионы… При систематическом ходе анализа, после отделения катионов I-V групп, катионы… Летучие соли щелочных металлов окрашивают пламя горелки. Это объясняется их восстановлением в пламени до нейтральных…Реакции ионов калия
2КCl + Na3[Co(NO2)6] = К2Na[Co(NO2)6]↓ + 2NaCl. Осадок заметно растворим в воде (S = 1,5∙10-3 М) и склонен к образованию… Na3[Co(NO2)6] + 3NaOH = Со(ОН)3↓ + 6NaNO2.Реакции ионов натрия
NaСl + KН2SbО4- = NaH2SbO4↓ + KCl. Дигидроантимонат натрия белый кристаллический осадок, растворимый в щелочах с…Реакции ионов аммония
NH4Сl +KOH- = NH3↑ + H2O+KCl. При значительной концентрации NH4+ выделяющийся аммиак можно определить по… а) по посинению влажной универсальной индикаторной или лакмусовой бумаги, помещенной над сосудом, в котором проводится…Особенности анализа катионов VI группы
а) присутствие катиона аммония мешает обнаружению калия и натрия при использовании KH2SbO4; б) при определении ионов K+ и Na+ реакции необходимо проводить в нейтральной… В связи с этим наличие NH4+ должно быть определено прежде, чем приступают к определению K+ и Na+. Для обнаружения иона…РЕАКЦИИ ОБНАРУЖЕНИЯ АНИОНОВ
Существует несколько классификаций анионов по группам (отношение к кислотам, окислителям, восстановителям и т.д.).
Таблица 2
Классификация анионов
| Характеристика | Состав группы | Групповой реагент |
| Соли бария малорастворимы в воде | I группа анионов SO42-, SO32-, СО32-, РO43-, SiO32-, S2O32-, BO2-, CrO42- и др. | BaCl2 в нейтральном или слабощелочном растворе |
| Соли серебра малорастворимы в воде и в 2 М HNO3 | II группа анионов Cl-, Br-, I-, S2- и др. | AgNO3 в присутствии 2M НNО3 |
| Соли серебра и бария растворимы в воде | III группа анионов NO3-, NO2- и др. | Группового реагента нет |
Общепринятого разделения анионов на группы нет. Наиболее широко применяется классификация анионов, основанная на реакциях осаждения, т.е. на их способности образовывать малорастворимые соли бария и серебра. Групповыми реагентами в этом случае являются растворы ВаС12 и AgNO3. Все анионы на основании этого признака могут быть разделены на три группы. Такая классификация анионов значительно облегчает изучение их свойств и аналитическое обнаружение (табл. 2). Так, использование групповых реагентов только для предварительного обнаружения той или иной группы, позволяет не производить реакций на все анионы отсутствующих групп.
Обнаружение большинства анионов основано на применении тех же реакций, какие использовались для обнаружения катионов. Так, если катион Ba2+ можно обнаруживать с помощью иона SO42-, то в ходе анализа смеси анионов сульфат-ион обнаруживают действием Ba2+.
Первая группа анионов
Анионы 1 группы с катионом Ba2+ образуют соли, малорастворимые в воде, но легко растворяющиеся в разбавленных минеральных кислотах (за исключением BaSO4). Поэтому групповой реагент хлорид бария осаждает анионы 1-й группы только в нейтральной (или слабощелочной) среде.
С AgNO3 анионы 1-й группы образуют осадки, растворимые в разбавленной НNO3, а некоторые даже в воде (Ag2SO4).
Реакции карбонат-ионов
Н2О + CO2 D Н2СО3 D H++ НСО3- D 2Н+ + СО32- . Из средних солей угольной кислоты в воде растворимы только карбонаты калия,… 1. Кислоты, в том числе и СН3СООН, разлагают карбонаты с выделением CO2:Реакции сульфат-ионов
1. Хлорид бария с сульфат-ионом образует белый кристаллический осадок BaSO4, практически нерастворимый в воде и в минеральных кислотах: Na2SO4 + BaCl2 = BaSO4↓ +2NaCl Этой реакцией можно обнаружить SO42- в присутствии всех анионов. Исключение составляют SO32- и S2-. При подкислении…Реакции фосфат-ионов
Фосфат-ион является анионом ортофосфорной кислоты H3РO4, которая относится к кислотам средней силы. Как трехосновная кислота она дает три типа… 1. Хлорид бария с фосфат-ионом образует в нейтральной или слабощелочной среде… NaHPO4 + BaCl2 =BaHPO4↓ +2NaCl.Вторая группа анионов
Групповой реагент – AgNO3 (в присутствии разбавленной НNО3). Большинство анионов I группы также образуют с нитратом серебра нерастворимые в воде соли, однако все они растворяются в азотной кислоте и обнаружению анионов II группы не мешают.
Реакции хлорид-ионов
Хлорид-ион является анионом сильной хлороводородной кислоты НС1. Большинство хлоридов растворимо в воде. Малорастворимы AgCl, Hg2Cl2, PbCl2, Cu2Cl2,… 1. Концентрированная серная кислота при нагревании разлагает сухие хлориды. … H2SO4 + NaCl = NaHSO4 + HCl↑.Третья группа анионов
Характерным общим свойством анионов этой группы является растворимость солей бария и серебра в воде. Группового реагента анионы 3-ей группы (NО3-, NO2-) не имеют.
Реакции нитрат-ионов
1. Сульфат железа (II) в присутствии концентрированной H2SO4 восстанавливает NO3- до NO, который с избытком Fe(II) образует комплексное соединение… 2NaNO3 + 6FeSO4 + 4H2SO4 = 2NO↑ + 3Fe2(SO4) + 4H2O, NO + FeSO4 = [Fe(NO)SO4].Лабораторные работы по качественному анализу
Работа 1
a) K+, NH4+, Ca2+, Ba2+ b) K+, NH4+, Ca2+, Ba2+, Fe2+, Fe3+.Работа 2
1. Определяют рН исследуемого раствора с помощью универсальной индикаторной… 2. Проводим анализ катионов дробным методом:ГЛАВА 4. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Количественный анализ – область деятельности аналитиков, которая связана с определением концентраций или количества химических веществ, входящих в состав анализируемых объектов.
С помощью количественного анализа находят массовые соотношения между элементами в соединениях, определяют количество растворенного вещества в определяемом объеме раствора или определяют содержание какого-либо элемента в однородной смеси веществ, например, углерода в нефти или в природном газе.
Количественный анализ нужен при оценке месторождений полезных ископаемых, для металлургии и химической промышленности, имеет значение для биологии и агрохимии, почвоведения, физиологии растений и т.п.
Количественному анализу обычно предшествует выяснение качественного состава образца, так как важно не только подтвердить наличие в образце того или иного определяемого компонента, но и выяснить, какие другие вещества сопутствуют определяемому соединению. Разделение на качественный и количественный анализ в какой-то степени условно, зависит от содержания определяемого компонента и возможностей выбранного метода химического анализа. Чисто качественное обнаружение веществ или элементов ("обнаружен" или "не обнаружен") имеет смысл только для общей характеристики объекта анализа. Ответ "не обнаружен" вовсе не означает, что этого компонента вообще нет в анализируемом объекте, просто выбранным методом он не обнаруживается. Как правило, наряду с обнаружением требуется и количественная оценка содержания: "много", "мало", "следы". При обнаружении микроколичеств вещества качественная характеристика вообще может потерять смысл. Например, такие распространенные элементы, как железо, алюминий, кальций, магний всегда присутствуют в минералах на уровне n∙10-8%. В этом случае необходимо установить, чему именно равна величина n.
Выбор метода анализа и методики определения конкретного компонента в конкретном анализируемом объекте определяется, прежде всего, поставленной задачей: необходимостью определять элементы, функциональные группы, химические соединения; провести анализ без разрушения образца или на расстоянии; определить компонент очень быстро и т. д.
Различие и многообразие решаемых в количественном анализе задач и различные требования к избирательности, экспрессности и особенно чувствительности и точности определения химических веществ приводят к тому, что аналитическая химия располагает большим числом химических, физических и биологических методов химического анализа. К классическим относят химические методы, как правило, гравиметрический и титриметрический. В этих методах используют донорно-акцепторные реакции с переносом протона (кислотно-основные), электрона (окислительно-восстановительные), электронной пары (комплексообразование), процессы осаждения, растворения и экстракции. Аналитический сигнал, например изменение окраски раствора, в основном фиксируют визуально.
Выполнение измерений, представление и обработка результатов химического анализа
Измерение аналитического сигнала
Первые этапы количественного химического анализа – это отбор и подготовка… Приобнаружении какого-либо вещества надежно фиксируют появление аналитического сигнала, при определении количества…Погрешность методов анализа
Содержание той или иной составной части анализируемого вещества не определяют одним измерением, а находят в результате ряда операций и измерений.… Систематические ошибки обусловлены постоянными причинами, связанными с… Все ошибки, обусловленные недостатками избранного метода анализа (например, не вполне количественным течением реакции,…Обработка результатов методом математической статистики
Общую погрешность метода можно оценить только с привлечением методов математической статистики. Эти методы исходят из идеализированного… , где х1 – подозрительно выделяющееся значение;Представление экспериментальных данных
Гравиметрические методы анализа
Гравиметрия является простым и точным, хотя довольно продолжительным методом анализа. В гравиметрии определяемое вещество переводят в химически… Гравиметрические методы подразделяют на методы отгонки, выделения и… Методы отгонки основаны на отгонке компонента пробы в виде летучего соединения с последующим определением массы…Требования к осаждаемой форме
2. Желательно, чтобы структура осадка позволяла достаточно быстро проводить его фильтрование. Поэтому, по возможности, кристаллические осадки должны… 3. Осаждаемая форма должна при прокаливании нацело превращаться в…Требования к весовой форме
2. Достаточная химическая устойчивость. Гравиметрическая форма не должна изменять свою массу на воздухе из-за поглощения паров воды и СО2 или… 3. Для точности определения желательно, чтобы гравиметрическая форма имела…Требования к осадителю
2. Выбираемый осадитель должен обладать селективностью по отношению к осаждаемому иону. В противном случае приходится предварительно удалять ионы,…Расчет количества осадителя
Необходимое количество осадителя вычисляют, исходя из содержания иона в растворе, а следовательно, и из величины навески анализируемого вещества.… AgNO3 + HCl = AgCl↓ + HNO3. Допустим, что для количественного определения ионов серебра растворили навеску AgNO3 0,5020 г. Из уравнения реакции…Образование осадков и их свойства
Форма выделяемого осадка зависит от индивидуальных свойств вещества и от условий осаждения. Например, осадок сульфата бария, выделенный из водных… Таблица 4Условия осаждения кристаллических и аморфных осадков
Осаждая кристаллические вещества, заботятся о том, чтобы получить достаточно крупные кристаллы. Для этого стараются по возможности уменьшить число… Аморфные осадки многих веществ обладают свойством переходить в коллоидное…Фильтрование
В гравиметрическом анализе применяют не обычную фильтровальную бумагу, а так называемые беззольные фильтры. В процессе изготовления их подвергают… Синяя лента – фильтры наиболее плотные, мелкопористые и медленно фильтрующие;… Белая лента – фильтры средней плотности, применяемые для отделения большинства кристаллических осадков.Вычисления в гравиметрическом анализе
, так как гравиметрической формой является определяемое вещество. Однако чаще массу определяемого компонента непосредственно не взвешивают. Например, при определении сульфат-ионов…Вопросы и задачи для самостоятельной подготовки
2. Каким требованиям должны удовлетворять осадки в гравиметрическом анализе? 3. Перечислите условия осаждения кристаллических и аморфных веществ. 4. Что такое осаждаемая форма? Какие требования предъявляются к ней?Титриметрический анализ
При титровании рабочий раствор добавляют порциями или непрерывно с небольшой постоянной скоростью до тех пор, пока не будет достигнута точка… Чтобы данную химическую реакцию можно было использовать в титровании,… Титриметрические методы анализа основаны на использовании самых разнообразых реакций: нейтрализации,…Классификация титриметрических методов анализа
| Метод титрования, тип реакции | Подгруппы методов | Вещества, применяемые для приготовления титрантов |
| Кислотно-основное Н3О+ + ОН- = 2Н2О | Ацидиметрия (Н3О+) Алкалиметрия (ОН-) | HCl, H2SO4 NaOH, Na2CO3, KOH |
| Окислительно-восстановительное aOx1+bRed2 = aRed1+bOx2 | Перманганатометрия Иодометрия Дихроматометрия | KMnO4 I2 K2Cr2O7 |
| Комплексометрическое M + L = ML | Меркуриметрия Комплексонометрия | Hg(NO3)2 ЭДТА |
| Осадительное | Аргентометрия Меркурометрия | AgNO3 Hg2(NO3)2 |
Почвоведы используют титриметрические методы при изучении обменной кислотности и емкости поглощения почв, суммы поглощенных оснований, щелочности почв, содержания в них подвижного натрия, хлорид-ионов и магния в водной вытяжке из почвы.
Способы выражения концентрации растворов
Масса вещества обозначается как m(А) (где А – химический символ вещества) и обычно измеряется в граммах или миллиграммах. Моль. За единицу количества вещества n(А) принят моль. Это такое количество… Молярная масса. Масса одного моля вещества называется молярной массой вещества. Ее обозначат буквой М и измеряют в…Техника работы
Мерные колбы. Мерные колбы служат для приготовления стандартных растворов и для разбавления исследуемых растворов до определенного объема. Это… колбы над меткой не должно быть капель жидкости, внутренние стенки колбы… Нагревать мерные колбы нельзя, иначе может произойти деформация стекла, что повлечет за собой изменение их…Растворы, применяемые в титриметрии
1) быть химически чистыми; 2) сравнительно хорошо растворимыми; 3) строго отвечать химической формуле;Расчеты в титриметрических методах анализа
n(A) = n(B) Так как n = cэ ∙V, то этот закон можно записать следующим образом: сэ(А)∙VА = cэ(В)∙VВКоэффициент поправки
В некоторых случаях не стремятся получить раствор точно требуемой концентрации (навеску вещества не берут точно теоретически рассчитанной), а вводят… сэ(А) = КА ∙ сэ(А)теор. Поправочный коэффициент равен отношению практически взятых величин навески или концентрации к теоретически…Метод кислотно-основного титрования
Этим методом определяют различные органические и неорганические кислоты и… Титрантами метода являются стандартные (титрованные) растворы сильных кислот и оснований. Из кислот чаще всего…Работа 1. Стандартизация раствора хлороводородной кислоты по тетраборату натрия
Бура удовлетворяет всем требованиям, предъявляемым к первичным стандартам - устойчива в широком интервале влажности воздуха, имеет большую массу… Na2B4O7 + 5H2O = 2NaH2BO3 + 2H3BO3 . Полученный раствор буры можно рассматривать как раствор борной кислоты, наполовину оттитрованный сильным основанием…Работа 2. Определение устранимой жесткости (щелочности) воды
Карбонатная жесткость воды почти полностью устраняется кипячением, при котором гидрокарбонаты разлагаются: Ca(HCO3)2 = CaCO3↓ + CO2↑ + H2O поэтому карбонатную жесткость называют устранимой или временной и определяют титрованием определенного объема воды…Работа 3. Определение содержания гидроксида натрия
Реагенты: 1. Хлороводородная кислота, НСl, 0,1 М раствор. 2. Индикатор метиловый оранжевый, 0,1%-ный водный раствор.Работа 4. Определение содержания хлороводородной кислоты
Реагенты: 1. Гидроксид натрия, NaOH, 0,1 М раствор. 2. Индикатор метиловый оранжевый, 0,1%-ный водный раствор.Вопросы для самостоятельной подготовки
1. Какие способы выражения концентраций вам известны? Что такое эквивалент, фактор эквивалентности, молярная масса эквивалента? 2. Что такое титрование? Дайте определение понятиям точка эквивалентности,… 3. Какие типы реакций применяются в титриметрическом анализе?Комплексонометрическое титрование
Вследствие низкой растворимости в воде сама кислота не подходит для… Универсальность ЭДТА связана с образованием циклов-хелатов. Возникновение нескольких пятичленных циклов приводит к…Работа 5. Определение общей жесткости воды
Общая жесткость воды (Жобщ) преимущественно обусловлена наличием в ней суммарных концентраций катионов Са2+ (кальциевая ЖCa) и Mg2+ (магниевая ЖMg).… Жесткость выражают в миллимолях на литр (ммоль/л), 1 ммоль/л соответствует… Жесткость воды колеблется в широких пределах: от 0,1-0,2 ммоль/л в реках и озерах, расположенных в зонах тайги и…Работа 6. Определение кальциевой и магниевой жесткости воды
Раздельное определение Са2+ и Mg2+ в воде основано на хорошей растворимости Ca(OH)2 и малой - Mg(OH)2, а также возможностью комплексонометрического… Реагенты: 1. Стандартный раствор ЭДТА, с(1/2 ЭДТА) = 0,05 М.Работа 7. Определение содержания меди
Ионы меди образуют с ЭДТА комплексы голубого цвета. Условия прямого титрования определяются выбранным металлоиндикатором. В присутствии мурексида,… Реагенты 1. Стандартный раствор ЭДТА, с(ЭДТА) = 0,025 М.Работа 8. Определение содержания железа (III)
Реагенты: 1. Стандартный раствор ЭДТА, с(ЭДТА) = 0,025 М. 2. Индикатор сульфосалициловая кислота, 25%-ный водный раствор.Вопросы для самостоятельной подготовки
1. Изложить сущность метода комплексонометрии. 2. Чему равен фактор эквивалентности ЭДТА? 3. Объяснить особенности прямого, обратного, вытеснительного и косвенного приемов комплексонометрического…Окислительно-восстановительное титрование
В зависимости от используемого титранта различают перманганатометрию, иодометрию, дихроматометрию, броматометрию. В этих методах в качестве… Из всех типов химических реакций, используемых в количественном анализе,… Отличительным признаком окислительно-восстановительных реакций является перенос электронов между реагирующими…Перманганатометрия
В зависимости от кислотности растворов реакция восстановления перманганат-иона протекает различно. В кислой среде реакция протекает по уравнению: … MnO4- + 8H+ + 5e- = Mn2+ + 4H2O (Ео = 1,51 B); в слабощелочной или нейтральной средах:Работа 9. Определение содержания железа (II)
В основе определения лежит реакция: 10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O, 5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O.Вопросы для самостоятельной подготовки
1. Каким требованиям должны удовлетворять реакции окисления-восста-новления, чтобы их можно было использовать для количественного анализа? 2. Назовите особенности окислительно-восстановительных реакций. 3. Как определяют конечную точку титрования в окислительно-восстановительных методах?Физико-химические методы анализа
В аналитической химии чистым называют вещество, в котором современными методами не удается обнаружить примеси. Например, спектрально чистыми… Для управления технологическими процессами в промышленности, а также… В физико-химических методах анализа широко используются химические реакции, которые сопровождаются изменением…Спектроскопические методы анализа
По типу оптических явлений различают спектроскопию испускания, поглощения и рассеяния. Спектроскопию испускания, в свою очередь, подразделяют на… По изучаемым объектам спектроскопию подразделяют на ядерную, атомную и… Эмиссионный спектральный анализ основан на изучении спектров испускания (излучения) или эмиссионных спектров различных…Электрохимические методы анализа
Эти методы основаны на измерении электрохимических свойств анализируемых образцов (электропроводности, электрического потенциала, величины силы… Электрогравиметрический метод основан на выделении из раствора определяемого… Потенциометрияоснована на измерении потенциала электрода, погруженного в раствор. Значение потенциала зависит от…Методы хроматографического анализа
Эти методы основаны на различиях в адсорбируемости веществ, константах ионного обмена, растворимости осадков и т.д. Хроматография – это метод… Все хроматографические методы можно рассматривать как совокупность… Хроматография – современный и высокоэффективный метод, позволяющий достаточно быстро и надежно определять содержание…Важнейшие физико-химические методы анализа
Вопросы для самостоятельной подготовки
2. Перечислите физические свойства веществ, которые используются в физико-химических методах анализа в качестве измеряемого параметра? 3. Какая общая зависимость лежит в основе всех физико-химических методов… 4. Какие методы относят к спектроскопическим методам анализа и на изучении каких свойств веществ они основаны?Решение расчетных задач
Титриметрические методы анализа
Пример 1. На титрование 10,00 мл раствора КОН затрачено 15,50 мл 0,1028 М раствора HCl . Вычислить молярную концентрацию раствора КОН. Решение. Вещества реагируют в эквимолярных количествах, поэтому в точке… n(HCl) = n(KOH) ; VHCl∙c(HCl) = VKOH∙c(KOH)Примеры решения задач на вычисление рН растворов
Известно, что как бы не изменялись концентрации ионов Н+ и ОН- их произведение во всяком водном растворе остается при данных условиях величиной практически постоянной и называется ионным произведением воды. Численное значение определено из данных по электропроводности воды и составляет при 25 ºС 1∙ 10-14.
определено из данных по электропроводности воды и составляет при 25 ºС 1∙ 10-14.
Ионному произведению воды соответствует формула КН2О= [H+] ∙ [OH-] = 10-14, если прологарифмировать это уравнение, то оно принимает следующий вид: рН + рОН = 14.
Значения рН растворов сильных кислот и оснований рассчитывают по формулам: рН = - lg[H+], pOH = - lg[OH-].
Пример 1.
Рассчитать рН раствора, в котором содержится 0,63 г HNO3.
Решение:
Рассчитаем молярную концентрацию HNO3: 
V = 1 л, М(HNO3) = 1+ 14 + 3∙16 = 63 г/ моль
c(HNO3) = 0,63/ 63 = 0,01 моль/л
рН = - lg [H+] = - lg (10-2) = 2
Ответ: рН = 2.
Пример 2.
Рассчитать рН раствора, в 1 л которого содержится 0,4 г гидроксида натрия.
Решение:
Найдем молярную массу NaOH и молярную концентрацию раствора NaOH: М(NaOH) = 23 + 16+ 1 = 40 г /моль; V = 1л;
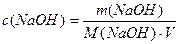 ;
;
с(NaOH) = 0,4 / 40 = 0,01 моль/л.
рОН = -lg [OH-] = - lg(10-2) = 2 рН = 14 – 2 = 12
Ответ: рН = 12.
Пример 3.
Сколько моль HCl требуется для приготовления 2 л раствора HCl, рН которого равно 1?
Решение:
рН = - lg [H+] 1 = - lg [H+]. Отсюда находим, что [H+] = 0,1 моль/л. Это значит, что в 1 л раствора HCl содержится 0,1 моль кислоты, а в 2 л будет 0,2 моль.
Ответ: 0,2 моль.
Задачи для самостоятельного решения
Ответ: ω(Na2CO3) = 53,39%. 2) Вычислить объем 0,1025 М раствора NaOH, израсходованный на титрование… Ответ: VNaOH = 4,87 мл.Приложение
Содержание курса «Химия (аналитическая)» для студентов
Геологического факультета
Программа составлена в соответствии с требованиями ГОС ВПО по специальности и… Содержание теоретического курса раскрывается в логической последовательности изучения разделов и тем. Каждый раздел и…Раздел 1. Теоретические основы аналитической химии
Тема 1.Предмет аналитической химии. Качественный и количественный анализ. Методы аналитической химии. Аналитические реакции, реагенты, чувствительность. Значение аналитической химии для геологии и народного хозяйства. Краткий очерк развития аналитической химии.
Теоретические основы развития аналитической химии. Скорость химической реакции. Химическое равновесие в гомогенных системах. Закон действия масс. Протолитическая теория кислот и оснований. Роль растворителя в кислотно-основном взаимодействии.
Степень электролитической диссоциации. Сильные и слабые электролиты. Константа диссоциации слабого электролита. Ионная сила раствора. Активность, коэффициент активности. Диссоциация воды. Водородный и гидроксильный показатели (рН и рОН).
Гидролиз солей, константа гидролиза. Действие одноименных ионов. Буферные растворы. Буферная емкость. Равновесие между жидкой и твердой фазами. Произведение растворимости. Условия образования осадков.
Тема 2. Качественный анализ
Тема 3. Количественный анализ
Титриметрический анализ. Классификация методов. Требования к реакциям, используемым в титриметрии. Способы выражения концентрации растворов. Расчеты… Комплексонометрическое титрование. Сущность метода. Прямое и обратное… Методы окислительно-восстановительного титрования. Окислительно-восстановительная пара. Окислительно-восстановительная…Литература
Основная.
1. Цитович И.К.Курс аналитической химии. СПб.: Лань, 2004. 496 с.
2. Аналитическая химия: учеб-метод. пособие / Перм. ун-т; сост. Л.И. Торопов, С.А. Денисова. Пермь, 2010. 110 с.
Дополнительная.
2. Дорохова Е.Н., Прохорова Г.В. Задачи и вопросы по аналитической химии. М.: Мир, 2001. 267 с. 3. Иванова М.А., Белоглазкина М.В., Богомолова И.В. и др. Аналитическая химия… 4. Основы аналитической химии. Кн. 1. Общие вопросы. Методы разделения / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева и…Денисова Светлана Александровна
Торопов Леонид Иванович
ХИМИЯ (АНАЛИТИЧЕСКАЯ)
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ ДЛЯ СТУДЕНТОВ
ГЕОЛОГИЧЕСКОГО ФАКУЛЬТЕТА
Редактор Н.И. Корректор А.В.– Конец работы –
Используемые теги: Денисова, Химический, анализ0.046
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Денисова С.А Химический анализ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов