Гравиметрические методы анализа
Гравиметрическим анализом называется метод количественного анализа, основанный на точном измерении массы определяемого компонента пробы, выделенного либо в элементарном виде, либо в виде соединения определенного состава.
Гравиметрия является простым и точным, хотя довольно продолжительным методом анализа. В гравиметрии определяемое вещество переводят в химически чистое состояние или превращают в весовую форму – соединение с точно известным постоянным составом, которое можно легко выделить и взвесить. Количество анализируемого вещества рассчитывают исходя из массы весовой формы и уравнения реакции, связывающей это вещество с весовой формой. Химические стандарты не требуются. Весовые методы анализа очень точны, их часто используют в сомнительных случаях в качестве контроля.
Гравиметрические методы подразделяют на методы отгонки, выделения и осаждения.
Методы отгонки основаны на отгонке компонента пробы в виде летучего соединения с последующим определением массы отогнанного вещества (прямое определение) или массы остатка (при косвенном определении). К прямым методам отгонки относится определение СО2, выделяющегося при разложении карбонатов:
CaCO3 + 2HCl = CO2↑ + CaCl2 + H2O.
Массу СО2 определяют по увеличению массы поглотительной трубки, заполненной асбестом, пропитанным NaOH и CaO:
CO2 + 2NaOH = Na2CO3.
Примером косвенного определения является метод определения кристаллизационной воды в неорганических соединениях, например:
tº
BaCl2∙2H2O ® BaCl2 + 2H2O.
При этом содержание кристаллизационной воды определяют по разности массы образца до и после прокаливания.
Методы выделения лежат в основе электрогравиметрического метода анализа, в котором определяемый компонент выделяется из раствора в результате электрохимических реакций, протекающих на электродах.
Среди гравиметрических методов анализа наиболее широко используют методы осаждения. В этих методах определяемый компонент осаждают в виде кокого-либо малорастворимого соединения. Выпавший осадок отделяют фильтрованием, тщательно промывают, прокаливают и точно взвешивают. По массе осадка и его формуле рассчитывают содержание в нем определяемого компонента. При осаждении всегда нужно брать некоторый избыток осадителя.
В гравиметрическом анализе различают осаждаемую и гравиметрическую формы. Первая – форма, в виде которой определяемое вещество осаждают из раствора при взаимодействии с соответствующим реагентом, вторая – в виде которой определяемое вещество взвешивают (ранее называлась «весовой» формой). Химические формулы осаждаемого соединения и взвешиваемого совпадают не всегда. Например, при определении сульфат-ионов путем осаждения их ионами Ba2+, формула осаждаемой и гравиметрической форм при соблюдении всех требуемых условий анализа одинакова:
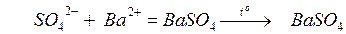
определяемое осаждаемая гравиметрическая
вещество форма форма
| |
 В некоторых гравиметрических методах определения путем осаждения формула взвешиваемого соединения отличается от формулы осадка. Например, при определении ионов железа, осаждаемых в виде гидроксида:
В некоторых гравиметрических методах определения путем осаждения формула взвешиваемого соединения отличается от формулы осадка. Например, при определении ионов железа, осаждаемых в виде гидроксида:

Для получения чистых, однородных по дисперсности, возможно крупнокристаллических осадков (если вещество кристаллическое), или хорошо скоагулированных осадков (если вещество аморфное), необходимо соблюдать ряд правил.