Расчет количества осадителя
Согласно правилу произведения растворимости образование осадков происходит лишь при условии, если произведение концентраций соответствующих ионов превысит величину ПР осаждаемого соединения при данной температуре.
Необходимое количество осадителя вычисляют, исходя из содержания иона в растворе, а следовательно, и из величины навески анализируемого вещества. Рассмотрим в качестве примера осаждение ионов Ag+ раствором HCl:
AgNO3 + HCl = AgCl↓ + HNO3.
Допустим, что для количественного определения ионов серебра растворили навеску AgNO3 0,5020 г. Из уравнения реакции видно, что 1 моль AgNO3 взаимодействует с 1 моль HCl. Рассчитаем сколько моль AgNO3 содержится во взятой навеске:
n(AgNO3) =  =
= 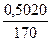 = 0,0030 моль.
= 0,0030 моль.
Следовательно, на взаимодействие с 0,0030 моль AgNO3 расходуется 0,0030 моль HCl. Если для осаждения использовали 1 М раствор кислоты, то в 1000 мл раствора содержится 1 моль HCl, а 0,0030 моль – соответственно в 3 мл.
Казалось бы, что для полного осаждения ионов Ag+ достаточно взять 3 мл 1 М раствора HCl. Однако это не так. Абсолютно нерастворимых веществ не существует, и над осадком хлорида серебра в растворе еще будут находиться неосажденные ионы Ag+. Поэтому необходимо настолько снизить их концентрацию, чтобы осаждение считалось практически полным. Жидкость над осадком представляет собой насыщенный раствор электролита. Произведение концентраций его ионов при неизменной температуре сохраняет свое значение, равное произведению растворимости, в рассматриваемом примере:
ПРAgCl = [Ag+]∙[Cl-] = 1,1∙10-7
Следовательно, чтобы понизить концентрацию ионов серебра, еще остающихся в растворе после осаждения, нужно повысить концентрацию хлорид-ионов, т.е. действовать избытком осадителя.
Опытным путем установлено, что для практически полного осаждения иона достаточно(1,5-2)-кратного избытка осадителя. Добавление большего избытка осадителя может повысить растворимость осадка вследствие образования комплексных соединений, кислых солей и т.д.