Константа диссоциации слабого электролита
Процесс диссоциации молекул электролита является обратимым. В растворе устанавливается равновесие между ионами и недиссоциированными молекулами, поэтому можно использовать закон действующих масс. Допустим, что ионизация слабого электролита протекает по схеме:
AB D A+ + B-;
Если обозначить равновесную концентрацию недиссоциированных молекул [AB], а концентрации ионов соответственно [A+] и [B-], то константа равновесия примет вид
 .
.
Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации. Ее величина зависит от природы электролита и растворителя, от температуры, но не зависит от концентрации раствора. Она характеризует способность данного электролита распадаться на ионы. Чем больше константа диссоциации, тем сильнее диссоциирует слабый электролит и тем выше концентрация его ионов в растворе. Принято обозначать константы диссоциации кислот символом Ка, а оснований – Кв. Например, реакцию диссоциации уксусной кислоты можно представить уравнением:
CH3COOH D H+ + CH3COO-.
Константа равновесия этой реакции (константа кислотности) имеет вид:  .
.
Многоосновные кислоты, а также основания двух- и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда. Например, диссоциация угольной кислоты происходит в две ступени:
H2CO3 D H+ + HCO3-
HCO3- D H+ + CO32-
Каждое равновесие характеризуется своей константой диссоциации. Для первой реакции ее обозначают К1, для второй - К2 :
K1 =  , К2 =
, К2 =  .
.
Суммарному равновесию
H2CO3 D 2H+ + CO32-
отвечает суммарная константа диссоциации К:
К =  .
.
Величины К, К1 и К2 связаны друг с другом соотношением: К = К1 ∙ К2.
Аналогичные соотношения характеризуют и ступенчатую диссоциацию гидроксидов многовалентных металлов. Например, двум ступеням диссоциации гидроксида бария:
Zn(OH)2 D ZnOH+ + OH-
ZnOH+ D Zn2+ + OH-.
отвечают константы диссоциации:
К1 =  и К2 =
и К2 =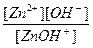 .
.
Суммарной диссоциации
Zn(OH)2 D Zn2+ + 2OH-
отвечает константа:
К = 
При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в меньшей степени, чем по предыдущей. Иначе говоря, соблюдается неравенство:
К1 > K2 > K3 …
Это объясняется тем, что энергия, которую нужно затратить для отрыва иона, минимальна при его отрыве от нейтральной молекулы и становится больше при диссоциации по каждой следующей ступени.
Если обозначить концентрацию электролита, распадающегося на два иона, через с, а степень его диссоциации в данном растворе через α, то концентрация каждого из ионов будет сα, а концентрация недиссоциированных молекул с(1 – α). Тогда уравнение константы диссоциации принимает вид:
К =  или К =
или К =  .
.
Это уравнение выражает закон разбавления Оствальда. Оно дает возможность вычислять степень диссоциации при различных концентрациях электролита, если известна его константа диссоциации, или вычислять константу диссоциации электролита, зная его степень диссоциации при той или иной концентрации.
Для растворов, в которых диссоциация электролита очень мала, т.е α << 1 уравнение закона Оствальда упрощается:
К = α2 с или  .
.
Это уравнение наглядно показывает связь, существующую между концентрацией слабого электролита и степенью его диссоциации: при разбавлении раствора степень диссоциации увеличивается.
Полученный вывод вытекает из природы явления диссоциации. Как всякое химическое равновесие, равновесие в растворе слабого электролита является динамическим, т.е. при его установлении протекают с равными скоростями два процесса: процесс диссоциации и обратный ему процесс образования молекул из ионов. При этом разбавление не препятствует процессу диссоциации. Однако процесс образования молекул из ионов в результате разбавления затрудняется: для образования молекулы должно произойти столкновение ионов, вероятность которого с разбавлением уменьшается.