Расчеты в титриметрических методах анализа
В основе всех количественных расчетов результатов анализа лежит закон эквивалентов, в соответствии с которым вещества реагируют между собой в строго определенных эквивалентных соотношениях, т.е. число молей эквивалентов определяемого вещества равно числу молей эквивалентов титранта:
n(A) = n(B)
Так как n = cэ ∙V, то этот закон можно записать следующим образом:
сэ(А)∙VА = cэ(В)∙VВ
Если молярная концентрация эквивалентов одного вещества известна, то, измеряя объемы реагирующих веществ, можно рассчитать неизвестную концентрацию второго вещества, например, вещества В:
cэ(B) = .
.
Например, раствор Ва(ОН)2 стандартизовали по 0,1280 М раствору НС1. Для титрования 25 мл раствора кислоты потребовалось 22,85 мл раствора основания. Следовательно,
с(1/2 Ba(OH)2) = с(HCl)∙VHCl/VBa(OH)2 = (0,1280∙25)/22,85 = 0,1400 М .
Для расчета массы вещества, которую необходимо взять для приготовления раствора используют формулу:
m(A) = VA∙ cэ(A) ∙ Mэ(A) ∙ 10-3 (г),
При этом учитывают молярную массу эквивалента определяемого вещества МЭ(А) и результат умножают на 10-3, поскольку все объемы выражают в миллилитрах, а концентрация выражена в молях эквивалентов в литре:
Для вычисления массы вещества по объему затраченного реагента используют формулу:
m(В) = VA ∙ cэ(A) ∙ Mэ(В) ∙10-3 (г).
Важно правильно определять фактор эквивалентности веществ, реагирующих в процессе титрования, так как условия титрования могут быть различными. Например, в кислотно-основном методе фактор эквивалентности может определяться используемым индикатором. Все расчеты в объемном анализе проводят с точностью в четыре значащие цифры.
Расчет результатов титрования зависит от способа титрования. По способу выполнения различают прямое, обратное титрование и титрование по заместителю. При прямом титровании титрант непосредственно добавляют к определяемому веществу. Если скорость реакции мала, или не удается подобрать индикатор, или наблюдаются побочные эффекты, например потери определяемого вещества вследствие летучести, можно использовать прием обратного титрования: добавить к определяемому веществу заведомый избыток титранта Т1, довести реакцию до конца, а затем найти количество не прореагировавшего титранта титрованием его другим реагентом Т2 с концентрацией сэ(Т2). Очевидно, что на определяемое вещество затрачивается количество титранта Т1, равное разности  . Содержание вещества m(А), г в аликвотной части анализируемого раствора рассчитывается по формуле:
. Содержание вещества m(А), г в аликвотной части анализируемого раствора рассчитывается по формуле:
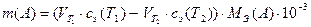 .
.
Если реакция нестехиометрична или протекает медленно, можно использовать титрование по заместителю. Для этого проводят стехиометрическую реакцию определяемого вещества с вспомогательным реагентом, а получающийся продукт оттитровывают подходящим титрантом. В этом случае расчет граммового содержания определяемого вещества ведут обычным для прямого титрования образом.