Диаграммы Eh-pH
Кислотность (рН) и окислительно-восстановительный потенциал (Eh) могут определять поведение элементов и их соединений в окружающей среде. Теоретически возможно бесконечное разнообразие сочетаний Eh-pH, хотя величина рН большинства сред на Земле находится между 0 и 14, обычно между 3 и 10. Окислительно-восстановительный потенциал ограничен присутствием воды. В сильно окислительных условиях (Eh 0,6-1,2 В) вода распадается на ионы кислорода и водорода, а в сильно восстановительных условиях (Eh 0,0 до -0,6 В) вода восстанавливается до водорода. Диаграммы Eh-pH используются для наглядного изображения влияния на формы химических соединений изменений кислотности или окислительно-восстановительных условий. Типичной является диаграмма для железа (рис. 15). Линии соответствуют условиям, при которых формы, находящиеся по обе их стороны, присутствуют в равных концентрациях. Точное положение линий изменяется в зависимости от активностей различных форм.
Из диаграммы становится ясно, что гематит (Fе2Оз) обычно устойчив в окислительных условиях при рН выше 4. Растворимый Fe3+ присутствует только в очень кислой среде из-за его тенденции к образование нерастворимых гидроксидов Fe2+ менее склонен к образованию нерастворимых гидроксидов. Таким образом, Fe2+ растворим при более высоких рН, но может существовать только в условиях низких Eh, которые предотвращают окисление до Fe3+. Небольшая область устойчивости распространенного пирита (FeS2) показывает, что этот минерал может образовываться только в восстановительных условиях, обычно при рН между 6 и 8.
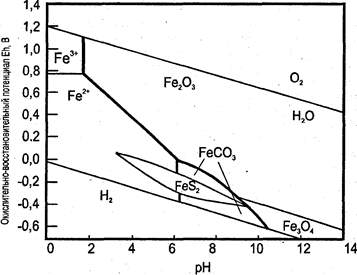
Рис. 15. Диаграмма Eh - рН для железа