рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Решение.
Реферат Курсовая Конспект
Решение.
Решение. - раздел Химия, АНАЛИТИЧЕСКАЯ ХИМИЯ Строим Калибровочный График А=F(C, Мг/мл) И По Нему Находим Концентрацию Ионо...
Строим калибровочный график А=f(C, мг/мл) и по нему находим концентрацию ионов железа 0,24 мг/мл, а затем рассчитываем массу железа в анализируемом растворе m(Fe3+)=C(Fe3+)·Vр-ра·M(Fe3+)=0,24·0,250 = 60 мг = 0,060 г.
9. КОНТРОЛЬНЫЕ ЗАДАНИЯ по теме «Инструментальные методы анализа» (контрольная работа № 3)
. Оптическая плотность при некоторой длине волны найдена равной А=0,562. Рассчитайте пропускание Т того же раствора в процентах
lgT=A-2.
. Удельная и эквивалентная электропроводность водного раствора хлорида бария при 250С равны соответственно 1,191∙10-3 Ом-1∙см-1 (за вычетом электропроводности чистой веды) и 119,1 Ом-1∙см-1∙моль-1. Рассчитайте молярную концентрацию эквивалента и молярную концентрацию хлорида бария в анализируемом растворе.
 .
.
. Кулонометрическое титрование 4,00 мл анализируемого раствора перманганата калия KMnO4 провели электрогенерированным железом (II) при постоянном токе i=50 мА в присутствии индикатора ферроина. Окраска раствора изменилась через 386 с. Рассчитайте молярную концентрацию перманганата калия в анализируемом растворе.

 .
.
. Для определения уксусной кислоты в ацетонитриле использовали метод кулонометрического титрования с помощью ионов ОН-, образующихся при электролизе воды в катодном пространстве. Какова молярная концентрация СН3СООН, если сила тока 25 мА, время электролиза 85 с, объем исследуемого раствора 60,0 см3.
. При амперометрическом титровании 10 см3 раствора цинка свежеприготовленным раствором К4[Fe(CN)6] с титром по цинку 0,002445 г/мл при Е=-1,46 В получены следующие данные:
| Объем титранта, см3 | 0,2 | 0,4 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | |
| Ток, мкА |
Построить график и определить молярную концентрацию цинка в исследуемом растворе.
. Определить нормальную концентрацию свинца, если при амперометрическом титровании 10,0 см3 этого раствора с помощью сульфата калия с титром 5,34∙10-3 г/мл при Е=1,0 В получили следующие данные:
| Объем титранта, см3 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | |
| Ток, мкА |
297. Определить степень диссоциации 0,1 М раствора HIO3, если удельная электропроводность этого раствора 4,02∙10-3 Ом-1∙см-1, а подвижности ионов  ,
,  .
.
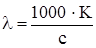 ;
;  ;
;  .
.
. Рассчитать массовую долю гексана, гептана и октана в смеси по методу внутренней нормализации (нормировки), если площади их пиков на хроматограмме равны 305, 508 и 122 мм2 соответственно.
 и т.д.
и т.д.
. Вычислить высоту, эквивалентную теоретической тарелке, если время удерживания некоторого компонента составляет 4 мин 40 с, а ширина пика на половине его высоты 34 с, длина колонки а) 3 м, б) 15 см. В каком случае реализован вариант высокоэффективной хроматографии?
 ,
,  ,
,
где H - высота, эквивалентная теоретической тарелке,R - время удерживания, ω1/2 - полуширина пика.
. Рассчитать молярную концентрацию эквивалента ионов меди в растворе, если при анализе 15 мл этого раствора высота полярографической волны восстановления Cu2+ (h) составила 20,00 мм, а после добавления 2,0 мл стандартного 0,0530 н. раствора хлорида меди (II) высота увеличилась до 24,3 мм.
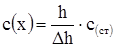 .
.
. Оптическое поглощение раствора окрашенного соединения железа, содержащего 1 мг/дм3 Fe3+ в монохроматическом свете в кювете с толщиной 3 см, равно 0,450. Определите молярное поглощение Fe3+ в этом соединении.
Ответ: 8400.
. Оптическое поглощение раствора вещества в кювете с l=3 см равно 0,750. Стандартный раствор, содержащий 5 мг/дм3 этого же вещества, имеет Аст=0,550 в кювете с l=5 см. Определите концентрацию раствора (в мг/дм3).
Ответ: 11,36 мг/дм3.
. Определите концентрацию рутина (витамина Р) (в моль/дм3 и мг/дм3), если оптическое поглощение анализируемого раствора А=0,780, а стандартного 6,1∙10-5 М раствора Аст=0,650 при 258 нм (Мрутина=610 г/моль).
Ответ: 7,32∙10-5 моль/дм3; 44,7 мг/дм3.
. При анализе салициловой кислоты (о-оксибензойная) на чистоту в тонком слое окиси алюминия в системе растворителей - петролейный эфир - этилацетат - уксусная кислота (85:10:5) и при проявлении в парах йода было получено два пятна с Rf, равным 0,63 и 0,72, и относительной интенсивностью 20:1. Определить, какое вещество и в каком количестве (в %) содержит салициловая кислота в виде примеси, если для данной системы имеем:
вещество - Rf
салициловая кислота - 0,63
эфир салициловой кислоты - 0,72
м-оксибензойная кислота - 0,82оксибензойная кислота - 0,90.
. Рассчитайте ОB потенциал редокс-пары IO3-,Н+/I- в водном растворе, для которого рН=2, а активности окисленной и восстановленной форм равны 1∙10-4 и 1∙10-2 моль/л соответственно. Стандартный ОB потенциал данной редокс-пары при комнатной температуре равен 1,08 В; число электронов, принимающих участие в ОB процессе, равно n=6.
Ответ: 0,94 B.
. Рассчитайте молярное поглощение окрашенного раствора Fe3+ с сульфосалициловой кислотой, содержащего 4∙10-3 г/дм3 Fe3+, если толщина слоя 2 см, а оптическое поглощение 0,56.
Ответ: 4∙103.
. Как изменится потенциал электрода, погруженного в раствор, содержащий хлорат-ионы ClO3- и хлорид-ионы Cl- при их одинаковых активностях, если рН этого раствора уменьшить от 5 до 1? Стандартный ОB потенциал редокс-пары ClO3-,H+/Cl- при комнатной температуре Е0=1,45 В; n=6.
Ответ: потенциал возрастет на 0,24 В.
. Вычислите концентрацию ионов серебра над осадком при 200С, если потенциал серебряного электрода, опущенного в раствор, равен 0,418 В по отношению к стандартному водородному электроду.
Ответ: 2,63∙10-7 моль/дм3.
. Определите концентрацию Cu2+ (в моль/дм3 и мг/дм3), если оптическое поглощение раствора аммиаката меди в кювете с l=2 см составляет 0,254, а молярное поглощение 423,3.
Ответ: 3∙10-4 моль/дм3; 19,2 мг/дм3.
. Вычислите реальный электродный потенциал медного электрода, опущенного в 0,02 н. раствор соли меди при 300С, относительно стандартного водородного электрода.
Ответ: +0,294 В.
. Вычислите ПРAgCl при 250С, если реальный электродный потенциал серебряного электрода, опущенного в насыщенный раствор AgCl, равен 0,518 В относительно водородного электрода.
Ответ: 1,69∙10-10.
. Величина пропускания стандартного раствора рибофлавина с концентрацией 5∙10-2 мг/мл при толщине кюветы 1 см составила 47,2%. Рассчитать концентрацию рибофлавина и его массу в 50 мл анализируемого раствора, если при его фотометрировании в тех же условиях получено Т=32,7%. Чему равны значения массового и молярного коэффициентов поглощения рибофлавина (М=376 г/молъ).
. Вычислите потенциал алюминиевого электрода в растворе, содержащем 13,35 г AlCl3 в 500 см3 раствора, при 300 С относительно водородного электрода.
Ответ: 1,656 В.
. Реальный ОВ потенциал редокс-пары Sn4+/Sn2+ при комнатной температуре равен 0,2 В. Рассчитайте, чему равно отношение активностей окисленной и восстановленной форм a(Sn4+)/a(Sn2+)в данном растворе. Стандартный ОВ потенциал указанной редокс-пары Е0=0,15 В.
Ответ: 50.
. Для стандартных растворов кофеина, теобромина, теофиллина рассчитали значения факторов удерживания: Rf кофеина = 0,873, Rf теобромина = 0,653, Rf теофиллина =0,461. Определить качественный состав анализируемой смеси, если на её хроматограмме растворитель прошел расстояние 4,5 см, а также имеются два пятна на расстоянии 3,93 и 2,1 см от линии старта.
. Рассчитать массу рутина (витамин Р, М=610 г/моль), которая содержится в 250 мл раствора, если оптическая плотность этого раствора при длине волны 258 нм и толщине кюветы 50 мм равна 0,780, а стандартного 6,1∙10-5 М раствора - 0,650. Чему равны значения молярного и массового коэффициентов поглощения рутина?
. При хроматографировании на бумаге величины Rf составили для фенобарбитала 0,5, для барбитала 0,7, для этаминала натрия 0,95. Какой из указанных барбитуратов присутствует в исследуемом растворе, если в тех же условиях при пробеге растворителя 12 см пятно оказалось на расстоянии 8,2 см от старта?
. Определите содержание Fe3+ (в мг/дм3), если оптическое поглощение раствора соли Fe3+ с сульфосалициловой кислотой в кювете толщиной 2 см равно 0,44. Оптическое поглощение стандартного раствора, содержащего 2 мг/дм3, равно 0,28.
Ответ: 3,14 мг/дм3.
. При каком значении рН водного раствора реальный ОB потенциал редокс-пары BrO3-,H+/Br- в кислой среде составляет Е=1,28 В при комнатной температуре, если активности окисленной и восстановленной форм одинаковы a(BrO3-)=а(Br-). Стандартный ОВ потенциал данной редокс-пары равен Е0=1,45 В; n=6.
Ответ: 2,88.
. Покажите, можно ли в стандартных состояниях веществ осуществить реакцию окисления хлорид-ионов Cl- ионами церия (IV). Стандартные ОВ потенциалы редокс-пар Се4+/Се3+ и Cl2/Cl- равны соответственно Е0=1,77 В и Е0=1,36 В.
Ответ: можно, т.к. ЭДС реакции положительна.
. Рассчитайте константу равновесия реакции
MnO4- + 5Br- + 8H+ = Mn2+ + 2,5Br2 +4H2O,
протекающей при комнатной температуре. Стандартные ОВ потенциалы редокс-пар MnO4-,H+/Mn2+ и Br2/Br- - равны соответственно 1,51 и 1,087 В.
Ответ: 7∙1035.
. Определите содержание меди (в %) в 10 г образца, 1 г которого растворили в мерной колбе вместимостью 100 см3. Оптическое поглощение полученного раствора в кювете с толщиной слоя 3 см составило 0,675, а ε =4,5∙104.
Ответ: 3,2∙10-3%.
. Оптическая плотность стандартного раствора рибофлавина с концентрацией 2,5∙10-2 мг/мл при толщине кюветы 1 см составила 0,324. Рассчитать концентрацию рибофлавина и его массу в 50 мл анализируемого раствора, если при его фотометрировании в тех же условиях получено значение А=0,486. Чему равны значения массового и молярного коэффициентов поглощения рибофлавина (М=376 г/моль).
. Рассчитайте константу равновесия К реакции Sn2++2Се4+=Sn4++2Ce3+, протекающей в водном растворе при комнатной температуре. Стандартные ОВ потенциалы редокс-пар Се4+/Ce3+ и Sn4+/Sn2+ при комнатной температуре соответственно равны 1,77 и 0,15 В.
Ответ: К=8,2∙1053.
. Оцените полноту окисления железа (II) при комнатной температуре двумя разными окислителями: раствором сульфата церия (IV) и раствором азотной кислоты HNO3. Стандартные ОВ потенциалы редокс-пар Се4+/Се3+; Fe3+/Fe2+ и NO3-,H+/NO равны соответственно 1,77, 0,77 и 0,96 В при комнатной температуре.
Ответ: К1/К2=8,9∙1016/4,6∙109=1,9∙107.
. Рассчитайте константу равновесия реакции 2I-+H2O2+2H+=I2+2H2O при комнатной температуре. Стандартные ОВ потенциалы редокс-пар I2/2I- и H2O2,H+/Н2O равны 0,621 и 1,77 В соответственно.
Ответ: 1039.
. При определении адипиновой кислоты в продукте гидрокарбоксилирования бутадиена методом бумажной хроматографии полученные пятна проявили метиловым красным, вырезали, высушили и взвесили. Для стандартных смесей с различным содержанием адипиновой кислоты получили данные:
| Масса кислоты, мкг | ||||
| Масса бумаги с пятном |
Навеску анализируемого образца массой 150 мг растворили в 20 мл воды и пробу полученного раствора 0,05 мл хроматографировали. Масса полученного пятна составила 107 мг. Определить массовую долю адипиновой кислоты в анализируемом продукте.
. Вычислите потенциал кадмиевого электрода в 0,05 н. Cd(NO3)2 относительно стандартного водородного электрода при 250С.
Ответ: 0,447 В.
. Рассчитайте реальный ОВ потенциал электрода, опущенного в раствор, в котором активности MnO4- и Mn2+ одинаковы, а рН=1. Стандартный ОВ потенциал редокс-пары MnO4-,H+/Mn2+ равен Е0=1,51 В при комнатной температуре.
Ответ: 1,42 В.
. Покажите, можно ли в стандартных состояниях веществ окислить хлорид-ионы Cl- перманганат-ионами MnO4- в кислой среде при комнатной температуре. Стандартные ОВ потенциалы редокс-пар MnO4-, H+/Mn2+ и Cl2/Cl- равны соответственно 1,51 и 1,36 В.
Ответ: можно, т.к. ε>0.
. Рассчитать массу рутина (витамин Р, М=610 г/моль), которая содержится в 250 мл раствора, если величина пропускания этого раствора при длине волны 256 нм и толщине кюветы 50 мм равна 16,6%, а стандартного 6,1∙10-5 М раствора - 28,2%. Чему равны значения молярного и массового коэффициентов поглощения рутина?
. Определите содержание Fe3+ (в мг/дм3), если оптическое поглощение его раствора с сульфосалициловой кислотой равно 0,45 в кювете толщиной 2 см, а ε=4∙103.
Ответ: 3,13 мг/дм3.
. Вычислите молярное поглощение раствора аммиаката меди (II), если оптическое поглощение его, содержащего 9,6 мг/дм3 Cu2+, в кювете толщиной 2 см равно 0,127.
Ответ: 423,3.
. Рассчитайте ОB потенциал редокс-пары Fe3+/Fe2+ при комнатной температуре при следующих условиях: а) активности окисленной и восстановленной форм равны: a(Fe3+)=a(Fe2+); б) отношение активностей а(Fe3+):a(Fe2+)=10; в) отношение активностей a(Fe3+):a(Fe2+)=0,1. Стандартный ОB потенциал данной редокс-пары при комнатной температуре равен Е0=0,771 В.
Ответ: 0,771; 0,830; 0,712 В.
. При хроматографировании на пластинках «Силуфол» и при использовании в качестве подвижной фазы смеси хлороформ-метанол (9:1) амидопирин, бутадион и димедрол имеют величины Rf, равные 0,60; 0,05; 0,95 соответственно. Какие из перечисленных лекарственных веществ содержатся в неизвестной смеси, если при ее хроматографировании в тех же условиях получены два пятна на расстоянии 4,8 см и 4 мм от стартовой линии, а растворитель прошел 8,0 см. Нарисовать вид хроматограммы.
. Для определения меди в препарате из навески его массой 0,325 г после растворения и обработки избытком аммиака было получено 250 мл окрашенного раствора, оптическая плотность которого в кювете с толщиной слоя 20 мм при длине волны = 620 нм равна 0,254. Рассчитать массовую долю меди в препарате, если молярный коэффициент поглощения аммиаката меди равен 423 моль-1∙л∙см-1.
. На пластинке силуфола после элюирования получили три пятна на расстоянии 24,37 и 49 мм. Растворитель «ушел» на 61 мм. Нарисовать хроматограмму, полученную на фотоденситометре.
. При хроматографировании на бумаге величины Rf составили для фенобарбитала 0,3, для барбитала 0,6, для этаминала натрия 0,85. Какой из указанных барбитуратов присутствует в растворе, если в тех же условиях при пробеге растворителя 14 см пятно оказалось на расстоянии 11,8 см от старта?
. Рассчитать массовую долю меди в препарате, если 1 г препарата растворили в мерной колбе вместимостью 100 мл в присутствии 8-оксихинолина, и оптическая плотность при длине волны 410 нм и толщине поглощающего слоя 30 мм составила 0,675. Молярный коэффициент поглощения комплекса меди с 8-оксихинолином равен 5,2∙103 моль-1∙л∙см-1.
. Определите ОВ потенциал редокс-пары BrO3-,H+/Br-, если концентрации c(BrO3-)=c(Br-)=c(H+)=0,01 моль/л, а стандартный ОВ потенциал этой редокс-пары при комнатной температуре Е0=1,45 В. ОВ-полуреакция может быть представлена в виде: BrO3- + 6H+ + 6ē = Br- + 3H2O.
Коэффициенты активности ионов принять равными единице.
Ответ: 1,33 В.
– Конец работы –
Эта тема принадлежит разделу:
АНАЛИТИЧЕСКАЯ ХИМИЯ
СОЦИАЛЬНОМУ РАЗВИТИЮ РФ... ИРКУТСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ... Фармацевтический факультет...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Решение.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов