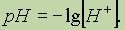Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Следовательно, реакции идут с образованием веществ с меньшей концентрацией ионов в растворе в соответствии с законом действующих масс. Скорость прямой реакции пропорциональна произведению концентраций ионов реагирующих компонентов, а скорость обратной реакции пропорциональна произведению концентраций ионов продуктов. Но при образовании газов, осадков и слабых электролитов ионы связываются (уходят из раствора) и скорость обратной реакции уменьшается.
Ионное произведение воды.Константа воды 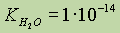 . Эту константу для воды называют ионным произведением воды. Ионное произведение воды зависит только от температуры; при повышении температуры оно увеличивается.
. Эту константу для воды называют ионным произведением воды. Ионное произведение воды зависит только от температуры; при повышении температуры оно увеличивается.
При диссоциации воды (см. уравнение выше) на каждый ион Н+ образуется один ион ОН- , следовательно, в чистой воде концентрации этих ионов должны быть одинаковы: [H+] = [ОН- ]. Используя значение ионного произведения воды, находим:

Такова концентрация ионов Н+ и ОН- в чистой воде. Рассмотрим, как изменится концентрация при добавлении других веществ, например соляной кислоты. Соляная кислота — сильный электролит, диссоциирующий в воде на ионы H+ и Cl- . Следовательно, концентрация ионов Н+ в растворе будет увеличиваться. Однако ионное произведение воды от концентрации не зависит, поэтому при увеличении [Н+] должна уменьшаться [ОН- ].
Напротив, если к воде добавить щелочь, то концентрация [ОН- ] увеличится, а[Н+] уменьшится. Таким образом, концентрации [Н+] и [ОН- ] взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот.
Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+]>10-7 моль/л, в нейтральных [Н+] = 10-7 моль/л, в щелочных [Н+]< 10-7 моль/л.
рН раствора.Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным показателем и обозначая ее рН: