рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Основные понятия химии
Реферат Курсовая Конспект
Основные понятия химии
Основные понятия химии - раздел Химия, Химия ...
Химия
ОСНОВЫ ТЕОРЕТИЧЕСКОЙ ХИМИИ
Основные понятия химии
Все химические вещества состоят из частиц, классификация которых в химии (и физике!) достаточно сложна; химические превращения связывают, прежде всего, с такими частицами, как атом, молекула, ядро, электрон, протон, нейтрон, атомные и молекулярные ионы, радикалы.
Атом.Принято считать, что атом — это наименьшая химическая частица вещества, хотя, как мы знаем, каждый атом состоит из так называемых “элементарных частиц”. Атом состоит из определенного числа протонов р, нейтронов n и электронов е. Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома.
Атом — электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов.
При этом выяснилось, что всю совокупность образовавшихся таким образом атомов легко классифицировать всего лишь по одному параметру — заряду ядра… Электрон. Первые указания о сложном строении атома были получены при изучении… Величины этих единичных зарядов электричества были определены в более поздних экспериментах по пропусканию…Атомные орбитали.Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
Орбиталъ — совокупность положений электрона в атоме, т. е. область пространства, в которой наиболее вероятно нахождение электрона.
Квантовые числа. Главное квантовое число nопределяет общую энергию электрона на данной орбитали. Оно может принимать любые целые значения, начиная с единицы(n = 1, 2, 3,...). Под главным квантовым числом, равным ¥ , подразумевают, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома).
В пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями. Существование различий в энергетическом состоянии электронов, принадлежащих к различным подуровням данного энергетического уровня, отражается побочным(иногда его называют орбитальным) квантовым числом l. Это квантовое число может принимать целочисленные значения от 0 до n - 1 (l =0, 1, ..., п - 1). Обычно численные значения l принято обозначать следующими буквенными символами:
Значение l: 0 1 2 3 4
Буквенное обозначение: s p d f g
В этом случае говорят о s-, p-, d- ,f-, g-состояниях электронов, или о s-, p-, d- ,f-, g-орбиталях.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака, а также орбитальный момент р — момент импульса электрона при его вращении вокруг ядра (отсюда и второе название этого квантового числа — орбитальное)
p = ħ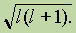
Таким образом, электрон, обладая свойствами частицы и волны, с наибольшей вероятностью движется вокруг ядра, образуя электронное облако, форма которого в s-, p-, d- ,f-, g-состояниях различна.
Форма электронного облака зависит от значения побочного квантового числа l. Так, если l = 0 (s-орбиталь), то электронное облако имеет сферическую форму (шаровидную симметрию) и не обладает направленностью в пространстве. При l = 1 (р-орбиталь) электронное облако имеет форму гантели, т. е. форму тела вращения, полученного из “восьмерки”. Формы электронных облаков d- ,f- и g-электронов намного сложнее.
Движение электрического заряда (электрона) но замкнутой орбите вызывает появление магнитного поля. Состояние электрона, обусловленное орбитальным магнитным моментом электрона(в результате его движения по орбите), характеризуется третьим квантовым числом — магнитным ml. Это квантовое число характеризует ориентацию орбитали в пространстве,выражая проекцию орбитального момента импульса на направление магнитного поля.
Соответственно ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля магнитное квантовое число ml может принимать значения любых целых чисел, как положительных, так и отрицательных, от -l до +l. включая 0, т.е. всего (2l + 1) значений. Например, при l = 0 ml = 0; при l = 1 ml = -1, 0, +1; при l = 3, например, магнитное квантовое число может иметь семь (2l + 1 = 7) значений: -3, -2, -1, 0,+1, +2,+3.
Таким образом, ml характеризует величину проекции вектора орбитального момента количества движения на выделенное направление. Например, р-орбиталь (“гантель”) в магнитном поле может ориентироваться в пространстве в трех различных положениях, так как в случае l = 1 магнитное квантовое число может иметь три значения: -1, 0, +1. Поэтому электронные облака вытянуты по координатным осям х, у и z, причем ось каждого из них перпендикулярна двум другим.
Для полного объяснения всех свойств атома была выдвинута гипотеза о наличии у электрона так называемого спина. Спин — это чисто квантовое свойство электрона, не имеющее классических аналогов. Спин — это собственный момент импульса электрона, не связанный с движением в пространстве.Для всех электронов абсолютное значение спина всегда равно s = ½. Проекция спина на ось z (магнитное спиновое число ms) может иметь лишь два значения: ms = + ½ или ms = -1/2.
Поскольку спин электрона s является величиной постоянной, его обычно не включают в набор квантовых чисел, характеризующих движение электрода в атоме, и говорят о четырех квантовых числах.
Так как при химических реакциях ядра реагирующих атомов остаются без изменения (за исключением радиоактивных превращений), то физические и химические свойства атомов зависят, прежде всего, от строения электронных оболочек атомов.
Принцип Паули. В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел n, l или ml. Зная принцип Паули, рассмотрим, сколько электронов в атоме может находиться на… В общем случае при любом заданном значении n электроны прежде всего отличаются побочным квантовым числом l принимающим…Правило Гунда. При данном значении l (т. е. в пределах определенного подуровня) электроны располагаются таким образам, чтобы суммарный спин был максимальным.
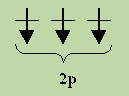
Если, например, в трех р-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т. е. размещаться на трех разных р-орбиталях:
Рассмотрим электронную конфигурацию атома четвертого периода 19К. Первые 18 электронов заполняют следующие орбитали: 1s22s22р63s23р6. Казалось бы, что девятнадцатый электрон атома калия 19К должен попасть на подуровень Зd, которому соответствуют п = 3 и l = 2. Однако на самом деле валентный электрон атома калия располагается на орбитали 4s. Дальнейшее заполнение оболочек после 18-го элемента происходит не в такой последовательности, как в двух первых периодах. Электроны в атомах располагаются в соответствии с принципом Паули и правилом Гунда, но так, чтобыих энергия была наименьшей.
Принцип наименьшей энергии. В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей его связи с ядром).
Энергия электрона в основном определяется главным квантовым числом п и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел п и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне Зd, так как в первом случае n + l = 4 + 0 = 4,аво втором n + l = 3 + 2 = 5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т. д.
В. М. Клечковский сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимально возможным значением n, а с наименьшим значением суммы n + l.
В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т. е. Зd-4р-5s и т. д.
Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули.
Химический элемент.Определенный вид атомов, характеризующийся одинаковым зарядом ядра, называется химическим элементом.
Каждый элемент имеет свое название и свой символ, например элементы гелий Не, медь Сu, фосфор Р и т. д. (см. периодическую таблицу).
Молекула.Следующей, более сложной после атома частицей может рассматриваться молекула.
Молекула — это электронейтральная наименьшая совокупность атомов, образующих определенную структуру посредством химических связей. Молекула — это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением.
Химическая формула.Наименование и символы элементов — химическая азбука, позволяющая описать состав любого вещества химической формулой.
Вещество.Молекулы могут содержать атомы только одного элемента, например молекула кислорода содержит два атома кислорода и описывается формулой О2, молекула озона состоит из трех атомов кислорода — О3, молекула белого фосфора — из четырех атомов фосфора Р4, молекула брома — из двух атомов Br2 и т. д.; такие вещества называют простыми веществами.
Вещества, молекулы которых состоят из атомов разных элементов, называют сложными веществами или химическими соединениями, например оксид водорода (вода) Н2О, азотная кислота HNO3, глюкоза С6Н12О6 и т. д.
Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру. Например, органические вещества, неметаллы (за небольшим исключением), оксид углерода (IV), вода. Большинство же твердых неорганических веществ не имеет молекулярной структуры: их решетка состоит не из молекул, а из других частиц (ионов, атомов); они существуют в виде макротел (кристалл хлорида натрия, друза кварца, кусок меди и др.). Не имеют молекулярной структуры соли, оксиды металлов, алмаз, кремний, металлы.
Химическая связь между молекулами у вещества с молекулярной структурой менее прочная, чем между атомами, поэтому их температуры плавления и кипения сравнительно низкие. У веществ с немолекулярной структурой химическая связь между частицами весьма прочная, поэтому их температуры плавления и кипения высокие. Современная химия изучает свойства микрочастиц (атомов, молекул, ионов и др.) и макротел.
Относительная атомная масса. Относительной атомной массой элемента называют отношение абсолютной массы атома к 1/12 части абсолютной массы атома изотопа углерода 12С. Обозначают относительную атомную массу элемента символом Аr, где r - начальная буква английского слова relative (относительный).
Относительная молекулярная масса. Относительной молекулярной массой Мr называют отношение абсолютной массы молекулы к 1/12 массы атома изотопа углерода 12С. Обратите внимание на то, что относительные массы по определению являются безразмерными величинами.
Таким образом, мерой относительных атомных и молекулярных масс избрана 1/12 часть массы атома изотопа углерода 12С, которая называется атомной единицей массы (а.е.м.):
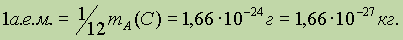
Абсолютные и относительные массы связаны простыми соотношениями:
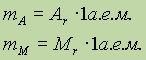
Моль.В химии чрезвычайное значение имеет особая величина — количество вещества.
Моль — это единица количества вещества, содержащая столько же структурных единиц данного вещества, сколько атомов содержится в 12 г углерода,… Число Авогадро. Определение моля базируется на числе структурных единиц,… Число частиц 6,02 × 1023 называется числом Авогадро или постоянной Авогадро и обозначается NA:NA = 6,02 × 1023 моль-1.
Молярная масса.Для удобства расчетов, проводимых на основании химических реакций и учитывающих количества исходных реагентов и продуктов взаимодействия в молях, вводится понятие молярной массы вещества.
Молярная масса М вещества представляет собой отношение его массы к количеству вещества:
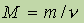 ,
,
где т — масса в граммах, n — количество вещества в молях, М — молярная масса в г/моль — постоянная величина для каждого данного вещества.
Значение молярной массы численно совпадает с относительной молекулярной массой вещества или относительной атомной массой элемента.
Классификация химических веществ. Индивидуальные вещества, смеси, растворы.Все вещества подразделяются на смеси и чистые вещества. Смесисостоят из нескольких веществ, каждое из которых сохраняет свои индивидуальные свойства и может быть выделено в чистом виде.
Смеси могут быть гомогенными (однородными) и гетерогенными (неоднородными). Примером гомогенной смеси могут служить растворы, гетерогенной — бетон, смесь сахара и соли и т.д.
Для получения чистых химических используются различные химические и физические методы очистки. Однако на практике любое вещество содержит какое-то количество примесей. При высокой степени очистки содержание последних настолько мало, что практически не влияет на химические и физические свойства веществ.
Химические вещества подразделяются на простые и сложные.
Простые вещества — это вещества, образованные из атомов одного элемента.
Понятие “простое вещество” нельзя отождествлять с понятием “химический элемент”. Простое вещество характеризуется определенной плотностью,…Сложные вещества, или химические соединения, — это вещества, образованные атомами разных элементов.
Сложные вещества состоят не из простых веществ, а из элементов. Например, вода состоит не из простых веществ водорода и кислорода, а из элементов… Аллотропия. В настоящее время известно 110 элементов, а число образуемыхими… Таким образом, явление аллотропии вызывается двумя причинами: 1) различным числом атомов в молекуле (например,…Валентность элементов в соединениях. Современные представления о природе химической связи основаны на электронной (спиновой) теории валентности, в соответствии с которой атомы, образуя связи, стремятся к достижению наиболее устойчивой (т. е. имеющей наименьшую энергию) электронной конфигурации. При этом электроны, принимающие участие в образовании химических связей, называются валентными.
Согласно спиновой теории, валентность атома определяется числом его неспаренных электронов, способных участвовать в образовании химических связей с другими атомами, поэтому понятно, что валентность всегда выражается небольшими целыми числами.
Степень окисления.Для полярных соединений также часто используют понятие степени окисления, условно считая, что такие соединения состоят только из ионов. Так, в галогеноводородах и воде водород имеет формально положительную валентность, равную 1+, галогены — формально отрицательную валентность 1-, кислород — отрицательную валентность 2-, как это обозначено в формулах Н+F-, Н+Сl-, Н+2О2-.
Понятие степени окисления было введено в предположении о полном смещении пар электронов к тому или другому атому (показывая при этом заряд ионов, образующих ионное соединение). Поэтому в полярных соединениях степень окисления означает число электронов, лишь смещенных от данного атома к атому, связанному с ним.
Совсем формальное понятие “степень окисления” используется при рассмотрении ковалентного соединения, поскольку степень окисления — это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов. В действительности никаких ионов в ковалентных соединениях нет.
Химические реакции
Закон сохранения массы и энергии. Масса веществ, вступающих в реакцию равна массе веществ, образующихся в результате реакции.
Взаимосвязь массы и энергии выражается уравнением Энштейна:
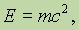
где Е – энергия; m – масса; с – скорость света в вакууме. Закон сохранения массы дает материальную основу для составления уравнений химических реакций и проведения расчетов по ним.
Закон постоянства состава. Состав соединений молекулярной структуры, т. е. состоящих из молекул, является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Стехиометрия.Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные отношения между реагирующими веществами. Стехиометрические количества – количества веществ, которые соответствуют уравнению реакции или формуле. Стехиометрические расчеты – расчеты по химическим формулам или уравнениям, а также вывод формул веществ и уравнений реакций.
Химические превращения. Наличие химических формул для всех веществ позволяет изображать химические реакции посредством химических уравнений. Наиболее характерными признаками химической реакции являются следующие внешние изменения реакционной среды: 1) выделение газа; 2) образование осадка; 3) изменение окраски; 4) выделение или поглощение теплоты.
Тепловые эффекты химических реакций.Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения образовавшихся газов.
По признаку выделения или поглощения теплоты реакции делятся на экзотермические и эндотермические.
Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами реагентов, называют тепловым эффектом химической реакции и обычно обозначают символом Q.
Наряду с тепловым эффектом термохимические процессы очень часто характеризуют разностью энтальпий D H продуктов реакции и исходных веществ.
Энтальпия Н — это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании.
При экзотермических реакциях, когда тепло выделяется, D Н отрицательно. При эндотермических реакциях(тепло поглощается) и D H положительно. Термохимические уравнения.На первых этапах изучения химии вы часто…Тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от промежуточных стадий реакций.
или через промежуточную стадию образования оксида углерода (II):А = В + С.
Бимолекулярные — это такие реакции, элементарный акт в которых осуществляется при столкновении двух молекул
А + В = С.
В тримолекулярных реакциях элементарный акт осуществляется при одновременном столкновении трех молекул
А + В = С.
Столкновение более чем трех молекул одновременно практически невероятно, поэтому реакции большей молекулярности на практике не обнаружены.
Скорость химической реакции.Основным понятием в химической кинетике является, понятие о скорости реакции:
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
Знак “-” в правой части уравнения появляется т. к. по мере протекания реакции… Обычно для реакций, протекающих в газах или растворах, концентрации реагентов выражают в моль/л, а скорость реакции —…Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ.
где k — коэффициент пропорциональности, который называется константой скорости… В случае бимолекулярной реакции, ее скорость определяется концентрацией молекул не только вещества А, но и вещества…Константа скорости химической реакции, ее зависимость от температуры.Многочисленные опыты показывают, что при повышении температуры скорость большинства химических реакций существенно увеличивается, причемдля реакций в гомогенных системах при нагревании на каждые десять градусов скорость реакции возрастает в 2—4 раза (правило Вант-Гоффа).
Это правило связано с понятием температурного коэффициента скорости реакции g и определяется соотношением
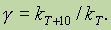
При температурах, не очень значительно изменяющихся, для многих реакций в соответствии с правилом
Вант-Гоффа g = 2 ¸ 4.
Значение температурного коэффициента g дает возможность рассчитать изменение скорости реакции при увеличении температуры на некоторое число градусов от Т1 до Т2 по формуле
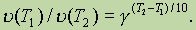
Очевидно, что при повышении температуры в арифметической прогрессии скорость реакции возрастает в геометрической.
Энергия активации.С. Аррениус впервые показал, что влияние температуры сводится к увеличению числа активных молекул, т. е. таких молекул, которые в момент столкновения обладают энергией, не меньше определенной для данной реакции величины, называемой энергией активации химической реакции.
Энергия активации — это некоторое избыточное количество энергии (по сравнению со средней), необходимое для вступления молекул в реакцию.
Согласно Аррениусу, константа скорости химической реакции зависит от температуры экспоненциально:
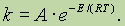
Здесь Е — энергия активации (Дж/моль), R — универсальная газовая постоянная, T — температура в К,
А — константа.
Явление катализа.Одно из наиболее сильных средств воздействия на скорость химических реакций — использование катализаторов.
Катализаторы. Катализатором называется вещество, изменяющее скорость химической реакции, но остающееся неизменным после того, как химическая реакция заканчивается.
Влияние катализаторов на скорость реакции называется катализом. Когда взаимодействующие вещества и катализатор находятся в одном агрегатном состоянии, говорят о гомогенном катализе. При гетерогенном катализе реагирующие вещества и катализатор находятся в различных агрегатных состояниях: обычно катализатор — в твердом, а реагирующие вещества — в жидком или газообразном (пример: в случае окисления SO2 в SO3 в присутствии платины или оксида ванадия (V) происходит гетерогенный катализ).
О механизмах гомогенного и гетерогенного катализа.Механизм действия катализаторов может быть самым разнообразным и, как правило, очень сложным. Основной гипотезой, объясняющей влияние катализатора на скорость реакции, является предположение об образовании промежуточных продуктов при взаимодействии катализатора и реагирующего вещества. Если химическая реакция А + В = АВ без катализатора происходит медленно, а в присутствии катализатора К быстро, то его действие объясняется тем, что катализатор реагирует с одним из исходных веществ, образуя непрочное (как правило, очень реакционноспособное) промежуточное соединение АК (илиВК):
А (В) + К = АК (ВК).
Образовавшееся промежуточное соединение (например.АК) взаимодействует с другим исходным веществом В, образуя конечный продукт реакцииАВ и выделяя катализатор К в первоначальном виде:
АК + В = АВ + К.
Приведенная простейшая схема катализа ясно показывает, почему каждая частица катализатора может принимать участие в реакции бесчисленное множество раз. (Правда, “бесчисленное” - только теоретически, потому что практически некоторые вещества, даже в очень малых количествах, могут резко снижать скорость каталитической реакции, уменьшая или полностью уничтожая активность катализатора. Такие вещества называют каталитическими ядами, а само явление снижения активности катализатора - отравлением.) Отсюда ясно, почему катализатор после окончания реакции остается количественно и химически неизменным.
Обратимые реакции.В химических реакциях исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаваться условия для протекания обратимой реакции в противоположном направлении.
Например, если смешать пары иода с водородом при температуре 200°С, то произойдет реакция:
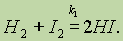
Однако известно, что йодистый водород уже при нагревании до 180 °С начинает разлагаться на иод и водород:
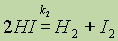
Понятно, что в этих условиях не произойдет ни полного разложения НI, так как продукты реакции способны вновь реагировать между собой, ни полного образования йодистого водорода. Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях. называются обратимыми.
При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Уравнение рассмотренной выше обратимой реакции запишется следующим образом:

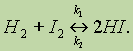
Реакцию, протекающую слева направо называют прямой (константа скорости прямой реакции k1), справа налево — обратной (константа скорости обратной реакции k2).
Химическое равновесие.В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реация в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными.
Состояние, в котором скорость обратной реакции становится равной скорости прямой реакции, называется химическим равновесием.
согласно закону действующих масс, скорости прямой реакции u 1 и обратной u 2…При увеличении давления равновесие смещается в сторону уменьшения числа молекул газообразных веществ, т. е. в сторону понижения давления: при уменьшении давления равновесие смещается в сторону возрастания числа молекул газообразных веществ, т. е. в сторону увеличения давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на положение равновесия в этой системе.
Температура. Повышение температуры увеличивает кинетическую энергию всех молекул, участвующих в реакции. Но молекулы, вступающие в реакцию, при которой происходит поглощение энергии (эндотермическая реакция), начинают взаимодействовать между собой быстрее. Это увеличивает концентрацию молекул, участвующих в обратной реакции, и ускоряет ее. В результате достигается новое состояние равновесия с повышенным содержанием продуктов реакции, протекающей с поглощением энергии.
При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении температуры — в сторону экзотермической реакции.
Строение атома
Вскоре после открытия нейтрона, была создана протонно-нейтронная теорию строения ядра. Согласно этой теории ядра всех атомов, кроме ядра атома… Массовое число А указывает суммарное число протонов Z и нейтронов N в ядре… A = Z + N.Периодический закон Д. И. Менделеева и периодическая система элементов
Менделеев считал, что основной характеристикой элементов являютсяих атомные веса, и в 1869 г. впервые сформулировал периодический закон: Свойства простых тел, а также формы и свойства соединений элементов находятся… Несмотря на всю огромную значимость такого открытия, периодический закон и система Менделеева представляли лишь…Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Периодическая таблица и электронные конфигурации атомов. В настоящее время известно более 500 вариантов изображения периодической системы: это различные формы передачи периодического закона.
Первым вариантом системы элементов, предложенным Д. И. Менделеевым 1 марта 1869 г., был так называемый вариант длинной формы. В этом варианте периоды располагались одной строкой. В декабре 1870 г. он опубликовал второй вариант периодической системы — так называемую короткую форму. В этом варианте периоды разбиваются на ряды, а группы — на подгруппы (главную и побочную).
В периодической системе по горизонтали имеется 7 периодов, из них первые три называются малыми, а остальные — большими. В первом периоде находится 2 элемента, во втором и третьем — по 8, в четвертом и пятом — по 18, в шестом — 32, в седьмом (незавершенном) — 21 элемент. Каждый период, за исключением первого” начинается щелочным металлом и заканчивается благородным газом (7-й период — незаконченный).
Все элементы периодической системы пронумерованы в том порядке, в каком они следуют друг за другом. Номера элементов называются порядковыми или атомными номерами.
В системе 10 рядов. Каждый малый период состоит из одного ряда, каждый большой период — из двух рядов: четного (верхнего) и нечетного (нижнего). В четных рядах больших периодов (четвертом, шестом, восьмом и десятом) находятся одни металлы, и свойства элементов в ряду слева направо изменяются слабо. В нечетных рядах больших периодов (пятого, седьмого и девятого) свойства элементов в ряду слева направо изменяются, как у типических элементов
Основным признаком, по которому элементы больших периодов разделены на два ряда, является их степень окисления. Их одинаковые значения дважды повторяются в периоде с ростом атомных масс элементов. Например, в четвертом периоде степени окисления элементов от К до Mn изменяются от +1 до +7, затем следует триада Fe, Со, Ni (это элементы четного ряда), после чего наблюдается такое же возрастание степеней окисления у элементов от Cu до Br (это элементы нечетного ряда). То же мы видим в остальных больших периодах, исключая седьмой, который состоит из одного (четного) ряда. Дважды повторяются в больших периодах и формы соединений элементов.
В шестом периоде вслед за лантаном располагаются 14 элементов с порядковыми номерами 58-71, называемых лантаноидами (слово “лантаноиды” означает подобные лантану”, а “актиноиды” — “подобные актинию”). Иногда их называют лантанидами и актинидами, что означает следующие за лантаном, следующие за актинием). Лантаноиды помещены отдельно внизу таблицы, а в клетке звездочкой указано на последовательность их расположения в системе: La-Lu. Химические свойства лантаноидов очень сходны. Например, все они являются реакционно-способными металлами, реагируют с водой с образованием гидроксида и водорода. Из этого следует, что у лантаноидов сильно выражена горизонтальная аналогия.
В седьмом периоде 14 элементов с порядковыми номерами 90-103 составляют семейство актиноидов. Их также помещают отдельно — под лантаноидами, а в соответствующей клетке двумя звездочками указано на последовательность их расположения в системе: Ас-Lr. Однако в отличие от лантаноидов горизонтальная аналогия у актиноидов выражена слабо. Они в своих соединениях проявляют больше различных степеней окисления. Например, степень окисления актиния +3, а урана +3, +4, +5 и +6. Изучение химических свойств актиноидов крайне сложно вследствие неустойчивости их ядер.
В периодической системе по вертикали расположены восемь групп (обозначены римскими цифрами). Номер группы связан со степенью окисления элементов, проявляемой ими в соединениях. Как правило, высшая положительная степень окисления элементов равна номеру группы. Исключением являются фтор — его степень окисления равна -1; медь, серебро, золото проявляют степень окисления +1, +2 и +3; из элементов VIII группы степень окисления +8 известна только для осмия, рутения и ксенона.
В VIII группе размещены благородные газы. Ранее считалось, что они не способны образовывать химические соединения.
Каждая группа делится на две подгруппы — главную и побочную, что в периодической системе -подчеркивается смещением одних вправо, а других влево. Главную подгруппу составляют типические элементы (элементы второго и третьего периодов) и сходные с ними по химическим свойствам элементы больших периодов. Побочную подгруппу составляют только металлы — элементы больших периодов. VIII группа отличается от остальных. Кроме главной подгруппы гелия она содержит три побочные подгруппы: подгруппу железа, подгруппу кобальта и подгруппу никеля.
Химические свойства элементов главных и побочных подгрупп значительно различаются. Например, в VII группе главную подгруппу составляют неметаллы F, С1, Вг, I, Аt, побочную — металлы Мn, Тc, Rе. Таким образом, подгруппы объединяют наиболее сходные между собой элементы.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения; существует всего 8 форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RО, R2O3, RO2, R2O5, RО3, R2O7, RO4, где R — элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы (главной и побочной), кроме тех случаев, когда элементы не проявляют степени окисления, равной номеру группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения, форм таких соединений 4. Их также изображают общими формулами в последовательности RН4, RН3, RН2, RН. Формулы водородных соединений располагаются под элементами главных подгрупп и только к ним относятся.
Свойства элементов в подгруппах закономерно изменяются: сверху вниз усиливаются металлические свойства и ослабевают неметаллические. Очевидно, металлические свойства наиболее сильно выражены у франция, затем у цезия; неметаллические — у фтора, затем — у кислорода.
Наглядно проследить периодичность свойств элементов можно и исходя из рассмотрения электронных конфигураций атомов.
Число электронов, находящихся на внешнем уровне в атомах элементов, располагающихся в порядке увеличения порядкового номера, периодически повторяется. Периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением строения их атомов, а именно числом электронов на их внешних энергетических уровнях. По числу энергетических уровней в электронной оболочке атома элементы делятся на семь периодов. Первый период состоит из атомов, в которых электронная оболочка состоит из одного энергетического уровня, во втором периоде — из двух, в третьем — из трех, в четвертом — из четырех и т. д. Каждый новый период начинается тогда, когда начинает заполняться новый энергетический уровень.
В периодической системе каждый период начинается элементами, атомы которых на внешнем уровне имеют один электрон, — атомами щелочных металлов — и заканчивается элементами, атомы которых на внешнем Уровне имеют2 (в первом периоде) или 8 электронов (во всех последующих) — атомами благородных газов.
Далее мы видим, что внешние электронные оболочки сходны у атомов элементов (Li, Na, К, Rb, Cs); (Ве, Mg, Са, Sr); (F, Сl, Вг, I); (Не, Nе, Аг, Kr, Хе) и т. д. Именно поэтому каждая из вышеприведенных групп элементов оказывается в определенной главной подгруппе периодической таблицы: Li, Na, К, Rb, Cs в I группе, F, Сl, Вг, I — в VII и т. д. Именно вследствие сходства строения электронных оболочек атомов сходны их физические и химические свойства.
Число главных подгрупп определяется максимальным числом элементов на энергетическом уровне и равно 8. Число переходных элементов (элементов побочных подгрупп) определяется максимальным числом электронов на d-подуровне и равно 10 в каждом из больших периодов.
Поскольку в периодической системе химических элементов Д. И. Менделеева одна из побочных подгрупп содержит сразу три переходных элемента, близких по химическим свойствам (так называемые триады Fe-Со-Ni, Ru-Rh-Pd, Os-Ir-Pt), то число побочных подгрупп, так же как и главных, равно 8.
По аналогии с переходными элементами число лантаноидов и актиноидов, вынесенных внизу периодической системы в виде самостоятельных рядов, равно максимальному числу электронов на f-подуровне, т. е. 14.
Период начинается элементом, в атоме которого на внешнем уровне находится один s-электрон: в первом периоде это водород, в остальных — щелочные металлы. Завершается период благородным газом: первый — гелием (1s2), остальные периоды — элементами, атомы которых на внешнем уровне имеют электронную конфигурацию ns2np6.
Первый период содержит два элемента: водород (Z=1) и гелий (Z= 2). Второй период начинается элементом литием (Z= 3) и завершается неоном (Z = 10). Во втором периоде восемь элементов. Третий период начинается с натрия (Z= 11), электронная конфигурация которого 1s22s22p63s1. С него началось заполнение третьего энергетического уровня. Завершается оно у инертного газа аргона (Z = 18), Зs- и 3p-подуровни которого полностью заполнены. Электронная формула аргона: 1s22s22p6Зs23p6. Натрий — аналог лития, аргон — неона. В третьем периоде, как и во втором, восемь элементов.
Четвертый период начинается калием (Z= 19), электронное строение которого выражается формулой 1s22s22p63s23p64s1. Его 19-й электрон занял 4s-подуровень, энергия которого ниже энергии Зd-подуровня. Внешний 4s-электрон придает элементу свойства, сходные со свойствами натрия. У кальция (Z = 20) 4s-подуро-вень заполнен двумя электронами: 1s22s22p63s23р64s2. С элемента скандия (Z = 21) начинается заполнение Зd-подуровня, так как он энергетически более выгоден, чем 4р-подуровень. Пять орбиталей 3d-подуровня могут быть заняты десятью электронами, что осуществляется у атомов от скандия до цинка (Z = 30). Поэтому электронное строение Sc соответствует формуле 1s22s22p63s23p63d14s2, а цинка - 1s22s22p63s23p63d104s2. В атомах последующих элементов вплоть до инертного газа криптона (Z=36) идет заполнение 4p-подуровня. В четвертом периоде 18 элементов.
Пятый период содержит элементы от рубидия (Z=37) до инертного газа ксенона (Z = 54). Заполнение их энергетических уровней идет так же, как у элементов четвертого периода: после Rb и Sr у десяти элементов от иттрия (Z = 39) до кадмия (Z=48) заполняется 4d-подуровень, после чего электроны занимают 5p-подуровень. В пятом периоде как и в четвертом, 18 элементов.
В атомах элементов шестого периода цезия (Z= 55) и бария (Z = 56) заполняется 6s-подуровень. У лантана (Z= 57) один электрон поступает на 5d-подуровень, после чего заполнение этого подуровня приостанавливается, а начинает заполняться 4f-поАуровень, семь орбиталей которого могут быть заняты 14 электронами. Это происходит у атомов элементов лантаноидов с Z = 58 — 71. Поскольку у этих элементов заполняется глубинный 4f-подуровеиь третьего снаружи уровня, они обладают весьма близкими химическими свойствами. С гафния (Z = 72) возобновляется заполнение d-подуровня и заканчивается у ртути (Z = 80), после чего электроны заполняют 6p-подуровень. Заполнение уровня завершается у благородного газа радона (Z= 86). В шестом периоде 32 элемента.
Седьмой период — незавершенный. Заполнение электронами электронных уровней аналогично шестому периоду. После заполнения 7s-подуровня у Франция (Z = 87) и радия(Z = 88) электрон актиния поступает на 6d-подуровень, после которого начинает заполняться 5f-подуровень 14 электронами. Это происходит у атомов элементов актиноидов с Z = 90 — 103. После 103-го элемента идет заполнение б d-подуровня: у курчатовия (Z = 104), нильсбория(Z=105), элементов Z = 106 и Z = 107. Актиноиды, как и лантаноиды, обладают многими сходными химическими свойствами.
Хотя 3 d-подуровень заполняется после 4s-подуровня, в формуле он ставится раньше, так как последовательно записываются все подуровни данного уровня.
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства).
1. s-Элементы: заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода.
2. р-Элементы: заполняется электронами р-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме первого и седьмого).
3. d-Элементы: заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два эле трона (у Pd — нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и р-элементами (их также называют переходными элементами).
4. f-Элементы: заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды.
В периодической системе s-элементов 14, р-элементов 30, d-элементов 35, f-элементов 28. Элементы одного типа имеют ряд общих химических свойств.
Периодическая система Д. И. Менделеева является естественной классификацией химических элементов по электроны структуре их атомов. Об электронной структуре атома, а значит, и свойствах элемента судят по положению элемента в соответствующем периоде и подгруппе периодической системы. Закономерностями заполнения электронных уровней объясняется различное число элементов в периодах.
Таким образом, строгая периодичность расположения элементов в периодической системе химических элементов Д. И. Менделеева полностью объясняется последовательным характером заполнения энергетических уровней.
Выводы:
Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 107 обусловливает периодическое повторение строения внешнего энергетического уровня. А поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются. В этом — физический смысл периодического закона.
В малых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 — в первом периоде, и от 1 до 8 — во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого периода) находится щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются свойства неметаллические.
В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда число электронов на внешнем уровне остается постоянным и равно 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в этих рядах изменяются крайне медленно. Лишь в нечетных рядах, когда с ростом заряда ядра увеличивается число электронов на внешнем уровне (от 1 до 8), свойства элементов начинают изменяться так же, как у типических.
В свете учения о строении атомов становится обоснованным разделение Д.И. Менделеевым всех элементов на семь периодов. Номер периода соответствует числу энергетических уровней атомов, заполняемых электронами. Поэтому s-элементы имеются во всех периодах, р-элементы — во втором и последующих, d-элементы — в четвертом и последующих и f-элементы — в шестом и седьмом периодах.
Легко объяснимо и деление групп на подгруппы, основанное на различии в заполнении электронами энергетических уровней. У элементов главных подгрупп заполняются или s-подуровни (это s-элементы), или р-подуровни (это р-элементы) внешних уровней. У элементов побочных подгрупп заполняется (d-подуровень второго снаружи уровня (это d-элементы). У лантаноидов и актиноидов заполняются соответственно 4f- и 5f-подуровни (это f-элементы). Таким образом, в каждой подгруппе объединены элементы, атомы которых имеют сходное строение внешнего электронного уровня. При этом атомы элементов главных подгрупп содержат на внешних уровнях число электронов, равное номеру группы. В побочные же подгруппы входят элементы, атомы которых имеют на внешнем уровне по два или по одному электрону.
Различия в строении обусловливают и различия в свойствах элементов разных подгрупп одной группы. Так, на внешнем уровне атомов элементов подгруппы галогенов имеется по семь электронов подгруппы марганца — по два электрона. Первые — типичные металлы, а вторые — металлы.
Но у элементов этих подгрупп есть и общие свойства: вступая в химические реакции, все они (за исключением фтора F) могут отдавать по 7 электронов на образование химических связей. При этом атомы подгруппы марганца отдают 2 электрона с внешнего и 5 электронов со следующего за ним уровня. Таким образом, у элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних (вторых снаружи) уровней, в чем состоит основное различие в свойствах элементов главных и побочных подгрупп.
Отсюда же следует, что номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом — физический смысл номера группы.
Итак, строение атомов обусловливает две закономерности: 1) изменение свойств элементов по горизонтали — в периоде слева право ослабляются металлические и усиливаются неметаллические свойства; 2) изменение свойств элементов по вертикали — в подгруппе с ростом порядкового номера усиливаются металлические свойства и ослабевают неметаллические. В таком случае элемент (и клетка системы) находится на пересечении горизонтали и вертикали, что определяет его свойства. Это помогает находить и писывать свойства элементов, изотопы которых получают искусственным путем.
Химическая связь
Образование устойчивой электронной конфигурации может происходить несколькими способами и приводить к молекулам (и веществам) различного строения,… Валентность элементов в соединениях. Современные представления о природе… Согласно спиновой теории, валентность атома определяется числом его неспаренных электронов, способных участвовать в…Энергия связи. Существенной характеристикой химической связи является ее прочность. Для оценки прочности связей обычно пользуются понятием энергии связей.
Энергия связи — это работа, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества. Чаще всего энергию связи измеряют в кДж/моль. Наиболее прочными являются ионные и ковалентные связи, энергии этих связей составляют величины от десятков до сотен кДж/моль. Металлическая связь, как правило, несколько слабее ионных и ковалентных связей, но величины энергий связи в металлах близки к значениям энергии ионных и ковалентных связей. Об этом свидетельствуют, в частности, высокие температуры кипения металлов, например 357 °С (Hg), 880 °С (Na), 3000 ° С (Fe) и т. д. Энергии водородных связей очень небольшие по сравнению с энергией межатомных связей. Так, энергия водородной связи составляет обычно величину 20—40 кДж/моль, тогда как энергия ковалентных связей может достигать несколько сотен кДж/моль.
Ионная связь. Ионная связь — это электростатическое взаимодействие между ионами с зарядами противоположного знака.
Валентность элементов в соединениях с ионными связями очень часто характеризуют степенью окисления, которая, в свою очередь, соответствует величине… Использование понятия степени окисления для атомов элементов, образующих… Ковалентная связь. Известно, что неметаллы взаимодействуют друг с другом. Рассмотрим образование простейшей молекулы…Разновидность ковалентной связи, образованной одинаковыми атомами, называют неполярной, а образованной разными атомами — полярной.
Полярность связи количественно оценивается дипольным моментом m , который является произведением длины диполя l — расстояния между двумя равными по величине и противоположными по знаку зарядами +q и -q — на абсолютную величину заряда:
M = l× q.
Дипольный момент является величиной векторной и направлен по оси диполя от отрицательного заряда к положительному. Следует различать дипольные моменты (полярность) связи и молекулы в целом. Так, для простейших двухатомных молекул дипольный момент связи равен дипольному моменту молекулы.
Напротив, в молекуле оксида углерода (IV) каждая из связей полярна, а молекула в целом неполярна (m =0), так как молекула О==С==О линейна, и дипольные моменты связей С==О компенсируют друг друга (см. рис.). Наличие дипольного момента в молекуле воды означает, что она нелинейна, т. е. связи О—Н расположены под углом, не равным 180° (см. рис.).
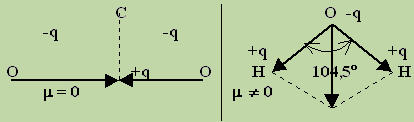
Электроотрицательность. Наряду с дипольными моментами для оценки степени ионности (полярности) связи используют и другую распространенную характеристику, называемую электроотрицательностью.
Электроотрицательность — это способность атома притягивать к себе валентные электроны других атомов. Электроотрицательность (ЭО) не может быть измерена и выражена в единицах каких-либо физических величин, поэтому для количественного определения ЭО предложены несколько шкал, наибольшее признание и распространение из которых получила шкала относительных ЭО, разработанная Л. Полингом.
По шкале Полинга ЭО фтора (наиболее электроотрицательного из всех элементов) условно принята равной4,0;на втором месте находится кислород, на третьем — азот и хлор. Водород и типичные неметаллы находятся в центре шкалы; значения их ЭО близки к 2. Большинство металлов имеют значения ЭО, приблизительно равные1,7 или меньше. ЭО является безразмерной величиной.
Шкала ЭО Полинга в общих чертах напоминает периодическую систему элементов. Эта шкала позволяет дать оценку степени ионностй (полярности) связи. Для этого используют зависимость между разностью ЭО и степенью ионности связи.
Чем больше разность ЭО, тем больше степень ионности. Разность ЭО, равная 1,7, соответствует 50%-ному ионному характеру связей, поэтому связи с разностью ЭО больше 1,7 могут считаться ионными, связи с меньшей разностью относят к ковалентным полярным.
Энергия ионизации. Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Она обычно выражается в электрон-вольтах. При отрыве электрона от атома образуется соответствующий катион.
Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра.
Энергия ионизации связана с химическими свойствами элементов. Так, щелочные металлы, имеющие небольшие энергии ионизации, обладают ярко выраженными металлическими свойствами. Химическая инертность благородных газов связана с их высокими значениями энергии ионизации.
Сродство к электрону.Атомы могут не только отдавать, но и присоединять электроны. При этом образуется соответствующий анион. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону. Обычно сродство к электрону, как и энергия ионизации, выражается в электрон-вольтах. Значения сродства к электрону известны не для всех элементов; измерять их весьма трудно. Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода.
Степень окисления в ковалентных соединениях.Для полярных соединений также часто используют понятие степени окисления, условно считая, что такие соединения состоят только из ионов. Так, в галогеноводородах и воде водород имеет формально положительную валентность, равную 1+, галогены — формально отрицательную валентность 1-, кислород — отрицательную валентность 2-: H+F- , H+Cl- , H2+O2- .
Понятие степени окисления было введено в предположении о полном смещении пар электронов к тому или другому атому (показывая при этом заряд ионов, образующих ионное соединение). Поэтому в полярных соединениях степень окисления означает число электронов, лишь смещенных от данного атома к атому, связанному с ним.
Совсем формальным понятие “степень окисления” становится, когда оно используется при рассмотрении ковалентного соединения, поскольку степень окисления — это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов. Ясно, что в действительности никаких ионов в ковалентных соединениях нет.
Различие между понятием степени окисления и валентности в ковалентных соединениях особенно наглядно можно проиллюстрировать на хлорпроизводных соединениях метана: валентность углерода везде равна четырем, а степень окисления его (считая степени окисления водорода 1+ и хлора 1- во всех соединениях) в каждом соединении разная: 4- СH4, 2- CH3Cl, 0CH2Cl2, 2+CHCl3, 4+CCl4.
Таким образом, нужно помнить, что степень окисления — условное, формальное понятие и, чаще всего не характеризует реальное валентное состояние атома в молекуле.
Донорно-акцепторная связь. Помимо механизма образования ковалентной связи, согласно которому общая электронная пара возникает при взаимодействии двух электронов, существует также особый до-норно-акцепторный механизм. Он заключается в том, что ковалентная связь образуется в результате перехода уже существующей электронной пары донора (поставщика электронов) в общее пользование донора и акцептора. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония (звездочками обозначены электроны внешнего уровня атома азота):
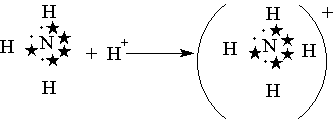
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи Н—N, образованные по различным механизмам, никаких различий в свойствах не имеют, т. е. все связи равноценны, независимо от механизма их образования. Указанное явление обусловлено тем, что в момент образования связи орбитали 2s- и 2р-электронов атома азота изменяют свою форму. В итоге возникают четыре совершенно одинаковые по форме орбитали (здесь осуществляется sp3-гибридизация).
В качестве доноров обычно выступают атомы с большим количеством электронов, но имеющие небольшое число неспаренных электронов. Для элементов II периода такая возможность кроме атома азота имеется у кислорода (две неподеленные пары) и у фтора (три неподеленные пары). Например, ион водорода Н+ в водных растворах никогда не бывает в свободном состоянии, так как из молекул воды Н2О и иона Н+ всегда образуется ион гидро-ксония Н3О+ Ион гидроксония присутствует во всех водных растворах, хотя для простоты в написании сохраняется символ H+.
Донорно-акцепторный механизм образования связи помогает понять причину амфотерности гидроксида алюминия: в молекулах Аl(ОН)3 вокруг атома алюминия имеется 6 электронов — незаполненная электронная оболочка. Для завершения этой оболочки не хватает двух электронов. И когда к гидроксиду алюминия прибавляют раствор щелочи, содержащей большое количество гидроксильных ионов, каждый из которых имеет отрицательный заряд и три неподеленные пары электронов (ОН)- , то ионы гидроксида атакуют атом алюминия и образуют ион [Аl(ОН)4]- , который имеет отрицательный заряд (переданный ему гидроксид-ионом) и полностью завершенную восьмиэлектронную оболочку вокруг атома алюминия.
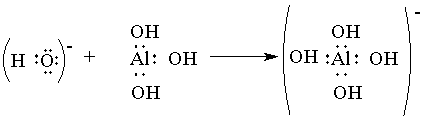
Аналогично происходит образование связей и во многих других молекулах, даже в таких “простых”, как молекула НNО3:
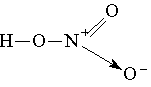
Атом азота при этом отдает свою электронную пару атому кислорода, который ее принимает: в результате как вокруг атома кислорода, так и вокруг азота достигается полностью завершенная восьмиэлектронная оболочка, но поскольку атом азота отдал свою пару и поэтому владеет ею совместно с другим атомом, он приобрел заряд “+”, а атом кислорода — заряд “-”. Cтепень окисления азота в HNO3 равна 5+, тогда как валентность равна 4.
Пространственное строение молекул. Представления о природе ковалентных связей с учетом типа орбиталей, участвующих в образовании химической связи, позволяют делать некоторые суждения о форме молекул.
Если химическая связь образуется с помощью электронов s-орбиталей, как, например, в молекуле Н2, то в силу сферической формы s-орбиталей не существует никакого преимущественного направления в пространстве для наиболее выгодного образования связей. Электронная плотность в случае р-орбиталей распределена в пространстве неравномерно, поэтому появляется некоторое выделенное направление, вдоль которого наиболее вероятно образование ковалентной связи.
Рассмотрим примеры, которые позволяют понять общие закономерности в направленности химических связей. Обсудим образование связей в молекуле воды H2O. Молекула H2O образуется из атома кислорода и двух атомов водорода. Атом кислорода имеет два неспаренных электрона, которые занимают две орбитали, расположенные под углом 90° друг к другу. Атомы водорода имеют неспаренные 1s-электроны. Ясно, что углы между двумя связями О—Н, образованными р-электронами атома кислорода с s-электронами атомов водорода, должны быть прямыми или близкими к нему (см. рис.).
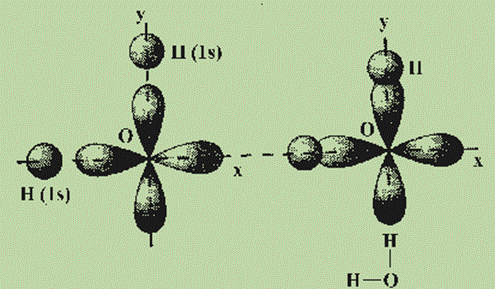
Аналогично, прямыми должны быть углы между связями в молекулах Н2О, H2S, F2О. Cl2O, РН3, РСl3 и т. д. Действительные значения углов между связями заметно отличаются от теоретических.
Увеличение валентных углов (> 90°) вполне объяснимо взаимным отталкиванием не связанных друг с другом атомов, которое мы не учитывали при предсказании углов между связями. Так, взаимное отталкивание атомов водорода в молекуле H2S слабее, чем в молекуле Н2О (так как радиус атома серы больше радиуса атома кислорода), поэтому и валентные углы Н—S—Н ближе к 90°, чем углы Н—О—Н.
Таким образом, двухвалентный атом неметалла с двумя валентными р-орбиталями образует изогнутую (угловую, с углом, близким к 90°) молекулу, а трехвалентный атом с тремя валентными р-орбиталями образует молекулу, имеющую форму пирамиды.
Гибридизация орбиталей. Рассмотрим образование молекулы метана СН4. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя р-электронами — ls22sl2p3.
Рассуждая как в случае H2O, можно было бы предполагать, что атом углерода будет образовывать три связи С—Н, направленные под прямым углом друг к другу (р-электроны), и одну связь, образованную s-электроном, направление которой было бы произвольным, поскольку s-орбиталь имеет сферическую симметрию.
Следовательно, можно было ожидать, что три связи С—Н в СН4 являются направленными p-связями и совершенно одинаковы, а четвертая связь есть ненаправленная s—s-связь и отличается от первых трех.
Однако экспериментальные данные показали, что все четыре связи С—Н в молекуле метана СН4 одинаковы и направлены к вершинам тетраэдра (угол между ними составляет 109,5°).
Ввиду относительной близости значений энергии 2s- и 2p-электронов эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
Четыре sp3-гибридные орбитали атома углерода расположены под углом 109,5° друг к другу, они направлены к вершинам тетраэдра, в центре которого находится атом углерода. Гибридная орбиталь сильно вытянута в одну сторону от ядра (см. рис.).
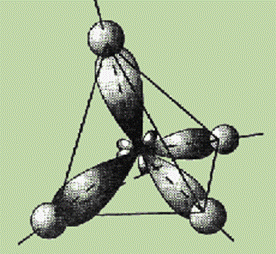
Это обусловливает более сильное перекрывание таких орбиталей с орбиталями электронов других атомов по сравнению с перекрыванием s- и р-орбиталей и приводит к образованию более прочных связей.
Таким образом, при образовании молекулы метана различные орбитали валентных электронов атома углерода — одна s-орбиталь и три р-орбитали — превращаются в четыре одинаковые “гибридные” sр3-орбитали (sp3-гибридизация). Этим и объясняется равноценность четырех связей атома углерода в молекуле.
Гибридизация оказывается характерной не только для соединений атома углерода. Гибридизация орбиталей может происходить в том случае, когда в образовании связей одновременно участвуют электроны, которые принадлежат к различным типам орбиталей.
Рассмотрим примеры различных видов гибридизации s- и р-орбиталей. Гибридизация одной s- и одной р-орбиталей (sp-гибридизация) происходит при образовании галогенидов бериллия, например BeF2, цинка, ртути, молекулы ацетилена и др. Атомы этих элементов в основном состоянии имеют на внешнем слое два спаренных s-электрона. В результате возбуждения один из электронов s-орбитали переходит на близкую по энергии р-орбиталь, т. е. появляются два неспаренных электрона, один из которых s-электрон, а другой р-электрон. При возникновении химической связи эти две различные орбитали превращаются в две одинаковые гибридные орбитали (тип гибридизации — sp), направленные под углом 180° друг к другу, т. е. эти две связи имеют противоположное направление (см. рис.).
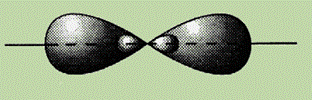
Экспериментальное определение структуры молекул BeX2, ZnX2, HgX2, C2H2 и т. д. (X — галоген) показало, что эти молекулы действительно являются линейными.
Остановимся подробнее на структуре молекулы ацетилена С2Н2. В молекуле ацетилена каждый атом углерода образует две гибридизированные связи, направленные под углом 180° друг к другу (см. рис.).
Как при образовании связейС—С, так и при образовании связей С—Н возникает общее двухэлектронное облако, образуя s -связи. В общем случае s -связью можно назвать связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.

Но в молекуле ацетилена атомы углерода находятся в sp-гибридных состояниях, т. е. в каждом из атомов углерода содержится еще по два р-электрона, которые не принимали участие в образовании s -связей. Молекула ацетилена имеет плоский линейный скелет, поэтому оба р-электронных облака в каждом из атомов углерода выступают из плоскости молекулы в перпендикулярном к ней направлении. В этом случае происходит также некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании s -связей. Таким образом, в молекуле ацетилена образуются еще две ковалентные углерод-углеродные связи, называемые p -связями (см. рис.).
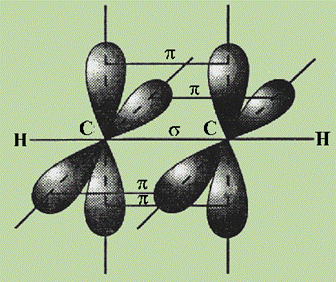
Случай образования кратных связей между атомами углерода для молекулы ацетилена — случай образования тройной связи, которая состоит из одной s - и двух p -связей. s -Связи являются более прочными, чем p -связи.
Еще один вид гибридизации s- и p-орбиталей осуществляется, например, в соединениях бора, алюминия или углерода (этилен бензол). Возбужденный атом бора имеет один s- и два p-электрона. В этом случае при образовании соединений бора происходит гибридизация одной s- и двух p-орбиталей (ps2-гибридизация), при этом образуется три одинаковые sp2–гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу (см. рис.).
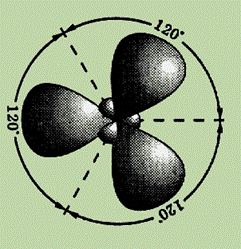
Эксперименты показали, что такие соединения как BF3, AlCl3, а также этилен и бензол имеют плоское строение и все три связи B¾ F(в молекуле BF3) расположены под углом 120° друг к другу.
Посредством образования sp2-гибридных орбиталей объясняются и структуры непредельных углеводородов.
Водородная связь. Само название этого типа связи подчеркивает, что в ее образовании принимает участие атом водорода. Водородные связи могут образовываться в тех случаях, когда атом водорода связан с электроотрицательным атомом, который смещает на себя электронное облако, создавая тем самым положительный заряд d + на водороде.
Водородная связь, как и другие рассмотренные нами типы связей, обусловлена электростатическим взаимодействием, но это взаимодействие осуществляется уже не между атомами, а между молекулами. Таким образом, водородная связь — пример межмолекулярной связи.
В качестве примера рассмотрим образование водородной связи между двумя молекулами воды. Связи О—Н в Н2О имеют заметный полярный характер с избытком отрицательного заряда d - на атоме кислорода. Атом водорода, наоборот, приобретает небольшой положительный заряд d + и может взаимодействовать с неподеленными парами электронов атома кислорода соседней молекулы воды.
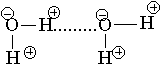
Водородная связь обычно схематично изображается точками.
Взаимодействие между молекулами воды оказывается достаточно сильным, таким, что даже в парах воды присутствуют димеры и тримеры состава (H2O)2, (Н2O)3 и т. д. В растворах же могут возникать длинные цепи ассоциатов такого вида:
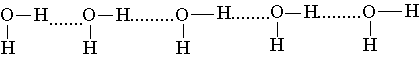
поскольку атом кислорода имеет две неподеленные пары электронов.
Таким образом, водородные связи могут образовываться, если есть полярная Х—Н связь и свободная пара электронов. Например, молекулы органических соединений, содержащие группы —ОН, —СООН, —CONH2, —NH2 и др., часто ассоциированы вследствие! образования водородных связей.
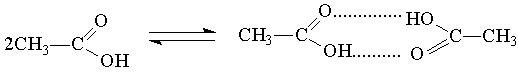 Типичные случаи ассоциации наблюдаются для спиртов и органических кислот. Например, для уксусной кислоты возникновение водородной связи может привести к объединению молекул в пары с образованием циклической димерной структуры, и молекулярная масса уксусycной кислоты, измеренная по плотности пара, оказывается удвоенной (120 вместо 60).
Типичные случаи ассоциации наблюдаются для спиртов и органических кислот. Например, для уксусной кислоты возникновение водородной связи может привести к объединению молекул в пары с образованием циклической димерной структуры, и молекулярная масса уксусycной кислоты, измеренная по плотности пара, оказывается удвоенной (120 вместо 60).
Водородные связи могут возникать как между различными молекулами, так и внутри молекулы, если в этой молекуле имеются группы с донорной и акцепторной способностями. Например, именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белков. По-видимому, наиболее важным и, несомненно, одним из наиболее известных примеров влияния внутримолекулярной водородной связи на структуру является дезоксирибонуклеиновая кислота (ДНК). Молекула ДНК свернута в виде двойной спирали. Две нити этой двойной спирали связаны друг с другом водородными связями.
Металлическая связь. Большинство металлов обладает рядом свойств, имеющих общий характер и отличающихся от свойств других простых или сложных веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к отражению света, высокая тепло- и электропроводность. Эти особенности обязаны существованию в металлах особого вида связи — металлической связи.
В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате этого в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из “электронного газа”. Как следствие этого, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве. В случае металлов невозможно говорить о направленности связей, так как валентные электроны распределены по кристаллу почти равномерно. Именно этим и объясняется, например, пластичность металлов, т. е. возможность смещения ионов и атомов в любом направлении без нарушения связи.
Агрегатные состояния вещества и переходы между ними
Если вещество находится при очень низкой температуре, частицы его обычно образуют правильную геометрическую структуру, в таком случае энергии связей… При повышении температуры энергия тепловых колебаний частиц возрастает, и для… При дальнейшем повышении температуры тепловые колебания увеличиваются, в результате частицы становятся практически не…Газы. Газовые законы.Если энергия притяжения между молекулами меньше их кинетической энергии, то совокупность таких молекул будет существовать в виде газа. Индивидуальное вещество в газообразном состоянии характеризуется следующими величинами: Р — давлением; Т или t — температурой, измеряемой в градусах Кельвина или Цельсия; V — объемом; m — массой всего газа; М — молярной массой. Газовые законы устанавливают взаимосвязь между этими величинами. При этом используется простейшая модель газообразного состояния веществ — идеальный газ, которая основана на следующих допущениях: 1) между частицами газа отсутствуют силы взаимодействия; 2) сами частицы представляют собой материальные точки.
Вначале были установлены газовые законы, справедливые для постоянной массы данного газа (т. е. m = const и М = const), и, кроме того, одна из оставшихся величин (Р, V, Т) также поддерживается постоянной.
T = const (изотермический процесс).
Взаимосвязь между изменением Р и V выражается законом Бойля—Мариотта:
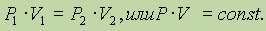
2. Р = const (изобарический процесс).
Взаимосвязь между изменением V и t выражается законом Гей-Люссака:
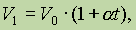
где a — коэффициент удельного объемного расширения, равный для всех газов 1/273 град- 1. Если это значение подставить в уравнение и температуру выразить в шкале Кельвина, то закон Гей-Люссака запишется так:
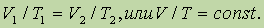
3. V = const (изохорический процесс).
Взаимосвязь между Р и t выражается законом Шарля:
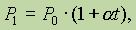

где a = 1/273 град- 1. В более удобной форме закон Шарля можно записать так:
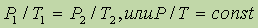
На основе трех частных законов можно легко вывести объединенный газовый закон, который выглядит следующим образом:
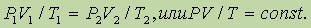
Объединенный газовый закон, как и частные законы, справедлив только для постоянной массы данного газа.
Уравнение Клапейрона—Менделеева. После того как было установлено экспериментально, что 1 моль любого газа при нормальных условиях (Р = 1 атм = 1,013 × 105 Па; t = 0 °С или T = 273 К) занимает объем 22,4 л, объединенный газовый закон для одного моля любого газа стали записывать так:
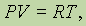
где R — универсальная газовая постоянная.
Действительно, объединенный газовый закон для любой постоянной массы газа (а значит, и для одного моля газа) имеет вышеприведенный вид, но и для одного моля газа const имеет одно и то же значение для всех реальных газов при таких условиях, при которых они ведут себя как идеальный газ. Обозначив эту постоянную R мы и получим последнее уравнение.
Газовая постоянная равна работе расширения 1 моля идеального газа при нагревании на 1 К при постоянном давлении.
Чтобы найти численное значение R, необходимо знать, какой объем занимает газ при каких-либо определенных значениях Р и T. Проще всего считать условия нормальными, тогда
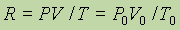
и в единицах СИ R =8,3144 Дж/(моль × К).
Как будут меняться левая и правая части объединенного газового закона для одного моля газа, если у нас будет не один, а n молей? Левая часть уравнения увеличивается в n раз, так как n молей займут в n раз больший объем, а правая часть не изменится (R — постоянная величина, а T не зависит от числа молей), тогда, Чтобы уравнение было справедливо для n молей, надо умножить правую часть на n :
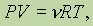
где n = m/М - число молей равно общей массе газа, деленной на молярную массу. Подставляя это значение в уравнение, получим:
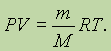
Уравнение идеального газа в форме двух последних уравнений и называется уравнением Клапейрона-Менделеева, оно выражает взаимосвязь между всеми величинами, характеризующими газ, а поэтому является наиболее общим в приближении модели идеального газа.
Из уравнения Клапейрона—Менделеева можно вывести ряд простых, но важных следствий.
1) Многие газовые реакции происходят при постоянных температуре и давлении. При этих условиях
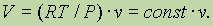
Это уравнение есть не что иное, как закон Авогадро, который утверждает, что в равных объемах газов при постоянных температуре и давлении содержится одинаковое число молекул.
2) Другое интересное следствие касается плотности газов. Из уравнения Клейперона - Менделеева следует, что
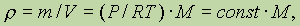
при постоянных P и T. Это означает, что при этих условиях плотность газа определяется только его молярной массой. Такой результат позволяет ввести понятие относительной плотности одного газа по другому:
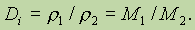
Эта величина показывает, во сколько раз первый газ тяжелее второго при одинаковых условиях.
3) Если реакция происходит в замкнутом сосуде (V =const) при постоянной температуре, то
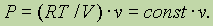
Это соотношение означает, что в замкнутом сосуде при заданных условиях давление зависит только от общего числа молекул газов.
Рассмотрим важное для многих задач понятие средней молярной массы смеси газов. Напомним, что для одного вещества молярная масса равна отношению массы к числу молей:
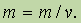
Точно такое же соотношение справедливо для смеси газов:
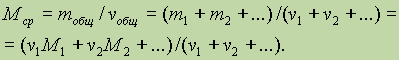
Поскольку газы в смеси всегда находятся при одинаковых условиях, то к ним применим закон Авогадро и определение средней молярной массы можно переписать, заменив число молей на объем:
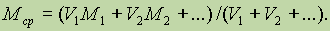
Переходы между агрегатными состояниями вещества в зависимости от температуры и давления. Диаграммы состояния. Различные агрегатные состояния вещества определяются, прежде всего, температурой и давлением: если давление мало, температура достаточно высока, то вещество будет находиться в газообразном состоянии, при низкой температуре вещество будет твердым, при умеренных (промежуточных) температурах — жидким. В соответствии с этим для количественной характеристики агрегатных состояний вещества часто используется очень наглядная фазовая диаграмма вещества, которая показывает зависимость агрегатного состояния от давления и температуры (см. рисунок).
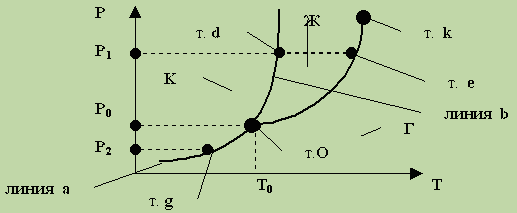
Диаграмма состоит из трех областей, отвечающих кристаллическому (К), жидкому (Ж) и газообразному (парообразному) (Г) состояниям. Эти области отделены друг от друга кривыми: плавление « кристаллизация Ob, кипение « конденсация Ok и сублимация « десублимация Оа. Точка пересечения этих кривых О называется тройной точкой: при Р = Р0 и Т = Т0 вещество может сосуществовать в трех агрегатных состояниях, причем жидкость и твердое вещество имеют одинаковое давление пара. Координаты Р = Р0 и T = Т0 тройной точки — это единственная пара значений давления и температуры, при которых одновременно могут сосуществовать три фазы. Пример: на диаграмме состояния воды этой точке соответствуют давление 4,58мм рт. ст. (0,61 кПа) и температура 273 К (0 °С).
При температуре выше критической (на диаграмме ей соответствует точка k) кинетическая энергия частиц становится больше энергии их взаимодействия, и поэтому вещество существует в газообразном состоянии при любом давлении.
На рисунке видно, что при давлении, большем Р0, нагревание твердого вещества приводит к его плавлению (при Р1 плавление происходит в точке d). После того как все вещество расплавится, дальнейшее повышение давления приводит к повышению соответствующих температур кипения (при давлении Р1 кипение жидкости происходит в точке е при температуре T1). При давлении, меньшем Р0 (при Р2) нагревание твердого вещества приводит к переходу из кристаллического состояния непосредственно в газообразное (в точке g), т. е. к сублимации. Для большинства веществ Р0 < Рнасыщ. паров. Лишь для немногих веществ р0 > Рнасыщ. паров, и нагревание кристаллов приводит к их сублимации — примерами таких веществ являются иод и “сухой лед” — твердый диоксид углерода.
Дисперсные и коллоидные системы. Растворы
Дисперсные системы.В природе и технике часто встречаются дисперсные системы, в которых одно вещество равномерно распределено в виде частиц внутри другого вещества.
В дисперсных системах различают дисперсную фазу — мелкораздробленное вещество и дисперсионную среду — однородное вещество, в котором распределена дисперсная фаза. Например, в мутной воде, содержащей глину, дисперсной фазой являются твердые частички глины, а дисперсионной средой — вода; в тумане дисперсная фаза — частички жидкости, дисперсионная среда — воздух; в дыме дисперсная фаза —- твердые частички угля, дисперсионная среда — воздух; в молоке — дисперсная фаза — частички жира, дисперсионная среда — жидкость и т. д.
К дисперсным системам относятся обычные (истинные) растворы, коллоидные растворы, а также суспензии и эмульсии. Они отличаются друг от друга прежде всего размерами частиц, т. е. степенью дисперсности (раздробленности).
Системы с размером частиц менее 1 нм представляют собой — истинные растворы, состоящие из молекул или ионов растворенного вещества. Их следует рассматривать как однофазную систему. Системы с размерами частиц больше 100 нм — это грубодисперсные системы — суспензии и эмульсии.
Суспензии — это дисперсные системы, в которых дисперсной фазой является твердое вещество, а дисперсионной средой — жидкость, — причем твердое вещество практически нерастворимо в жидкости. Чтобы приготовить суспензию, надо вещество измельчить до тонкого порошка, высыпать в жидкость, в которой вещество не растворяется, и хорошо взболтать (например, взбалтывание глины в воде). Со временем частички выпадут на дно сосуда. Очевидно, чем меньше частички, тем дольше будет сохраняться суспензия.
Эмульсии — это дисперсные системы, в которых и дисперсная фаза и дисперсионная среда являются жидкостями, взаимно не смешивающихся. Из воды и масла можно приготовить эмульсию длительным встряхиванием смеси. Примером эмульсии является молоко, в котором мелкие шарики жира плавают в жидкости. Суспензии и эмульсии — двухфазные системы.
Коллоидные системы. Коллоидные растворы— это высокодисперсные двухфазные системы, состоящие из дисперсионной среды и дисперсной фазы, причем линейные размеры частиц последней лежат в пределах от 1 до 100 нм. Как видно, коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями. Коллоидные частицы обычно состоят из большого числа молекул или ионов.
Коллоидные растворы иначе называют золями.Их получают дисперсионными и конденсационными методами. Диспергирование чаще всего производят при помощи особых “коллоидных мельниц”. При конденсационном методе коллоидные частицы образуютсяза счет объединения атомов или молекул в агрегаты. Так, если возбудить в воде дуговой электрический разряд между двумя проволоками из серебра, то пары металла конденсируются в коллоидные частицы. При протекании многих химических реакций также происходит конденсация и образуются высокодисперсные системы (выпадение осадков, протекание гидролиза, окислительно-восстановительные реакции и т.д.).
Золи обладают рядом специфических свойств, которые подробно изучает коллоидная химия. Золи в зависимости от размеров частиц могут иметь различную окраску, а у истинных растворов она одинаковая. Например, золи золота могут быть синими, фиолетовыми, вишневыми, рубиново-красными.
В отличие от истинных растворов для золей характерен эффект Тиндаля, т. е. рассеяние света коллоидными частицами. При пропускании через золь пучка света появляется светлый конус, видимый в затемненном помещении. Так можно распознать, является данный раствор коллоидным или истинным.
Одним из важных свойств золей является то, что их частицы имеют электрические заряды одного знака. Благодаря этому они не соединяются в более крупные частицы и не осаждаются. При этом частицы одних золей, например металлов, сульфидов, кремниевой и оловянной кислот, имеют отрицательный заряд, других, например гидроксидов, оксидов металлов, — положительный заряд. Возникновение заряда объясняется адсорбцией коллоидными частицами ионов из раствора.
Для осаждения золя необходимо, чтобы его частицы соединились в более крупные агрегаты. Соединение частиц в более крупные агрегаты называется коагуляцией, а осаждение их под влиянием силы тяжести — седиментацией.
Обычно коагуляция происходит при прибавлении к золю: 1) электролита, 2) другого золя, частицы которого имеют противоположный заряд, и 3) при нагревании.
При определенных условиях коагуляция золей приводит к образованию студенистой массы, называемойгелем. В этом случае вся масса коллоидных частиц, связывая растворитель, переходит в своеобразное полужидкое-полутвердое состояние. От гелей следует отличать студни — растворы высокомолекулярных веществ в низкомолекулярных жидкостях (системы гомогенные). Их можно получить при набухании твердых полимеров в определенных жидкостях.
Значение золей исключительно велико, так как они более распространены, чем истинные растворы. Протоплазма живых клеток, кровь, соки растений — все это сложные золи. С золями связано получение искусственных волокон, дубление кож, крашение, изготовление клеев, лаков, пленок, чернил. Много золей в почве, и они имеют первостепенное значение для ее плодородия.
Растворы. Растворами называются гомогенные (однородные) системы, содержащие не менее двух веществ. Т. е. могут существовать растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость.
Механизм образования растворов.Процесс растворения твердых веществ в жидкостях можно представить так: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему объему растворителя. Если растворитель соприкасается с большим количеством вещества, то через некоторое время раствор становится насыщенным. Таким образом, в процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя качественно новую однородную систему.
Растворение веществ сопровождается тепловым эффектом: выделением, или поглощением теплоты — в зависимости от природы вещества. При растворении в воде, например, гидроксида калия, серной кислоты наблюдается сильное разогревание раствора, т.е. выделение теплоты, а при растворении нитрата аммония — сильное охлаждение раствора, т.е. поглощение теплоты. В первом случае осуществляется экзотермический процесс (D Н < 0), во втором — эндотермический (D H > 0). Теплота растворения D H — это количество теплоты, выделяющееся или поглощающееся при растворении 1 моль вещества. Так, для гидроксида калия D Н0 = -55,65 кДж/моль, а для нитрата аммония D Н0 = +26,48 кДж/моль.
В результате химического взаимодействия растворенного вещества с растворителем образуются соединения, которые называют сольватами (или гидратами, если растворителем является вода). Образование таких соединений роднит растворы с химическими соединениями.
Сольваты (гидраты) образуются за счет донорно-акцепторного, ион-дипольного взаимодействия, за счет водородных связей, а также дисперсионного взаимодействия (в случае растворов родственных веществ, например бензола и толуола).
Особенно склонны к гидратации (соединению с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы. Поэтому, например, в растворе ион меди (II) голубой, в безводном сульфате меди он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном виде, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды.
Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами, а вода, входящая в состав кристаллогидратов, называется кристаллизационной. Кристаллогидратами являются многие природные минералы. Ряд веществ (в том числе и органические) получаются в чистом виде только в форме кристаллогидратов.
Таким образом, растворение — не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя.
Растворимость веществ.По растворимости в воде все вещества делятся на три группы: 1) хорошо растворимые, 2) малорастворимые и 3) практически нерастворимые. Последние называют также нерастворимыми веществами. Однако следует отметить, что абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку или кусочек золота или серебра, то они в ничтожно малых количествах все же растворяются в воде. Как известно, растворы серебра или золота в воде убивают микробов. Стекло, серебро, золото - это примеры практически нерастворимых в воде веществ (твердые вещества). К ним следует также отнести керосин, растительное масло (жидкие вещества), благородные газы (газообразные вещества).
Примером малорастворимых в воде веществ могут служить гипс, сульфат свинца (твердые вещества), диэтиловый эфир, бензол (жидкие вещества), метан, азот, кислород (газообразные вещества).
Многие вещества в воде растворяются весьма хорошо. Примером таких веществ могут служить сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества), хлороводород, аммиак (газообразные вещества).
Из приведенных примеров следует, что растворимость прежде всего зависит от природы веществ. Кроме того, она зависит также от температуры и давления. Сам процесс растворения обусловлен взаимодействием частиц растворимого вещества и растворителя; это самопроизвольный процесс.
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. С другой стороны, по относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным.
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют растворимостьюэтого вещества, или коэффициентом растворимости:
 ,
, 
Зависимость растворимости веществ от температуры и природы растворителя.Растворимость веществ существенно зависит от природы растворяемого вещества и растворителя, температуры и давления. Причины различной растворимости веществ до конца не выяснены, хотяих связывают с характером взаимодействия молекул растворителя и растворенного вещества. Например, известно, что молекулярные кристаллы, структурными единицами которых являются молекулы с ковалентным неполярным типом связи (сера и др.), практически нерастворимы в воде, так как энергия разрушения кристаллической решетки настолько велика, что не может быть компенсирована теплотой сольватации, которая очень мала.
Еще до обоснования теории растворов опытным путем было установлено правило, согласно которому подобное растворяется в подобном. Так, вещества с ионным (соли, щелочи) или полярным (спирты, альдегиды) типом связи хорошо растворимы в полярных растворителях, в первую очередь в воде. И наоборот, растворимость кислорода в бензоле, например, на порядок выше, чем в воде, так как молекулы О2 и С6Н6 неполярны.
Для подавляющего большинства твердых тел растворимость увеличивается с повышением температуры.
Если раствор, насыщенный при нагревании, осторожно охладить так, чтобы не выделялись кристаллы соли, то образуется пересыщенный раствор. Пересыщенным называют раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем в насыщенном растворе. Пересыщенный раствор неустойчив, и при изменении условий (при встряхивании или внесении в раствор затравки для кристаллизации) выпадает осадок, над которым остается насыщенный раствор.
В отличие от твердых тел растворимость газов в воде с повышением температуры уменьшается, что обусловлено непрочностью связи между молекулами растворенного вещества и растворителя. Другой важной закономерностью, описывающей растворимость газов в жидкостях, является закон Генри: Растворимость газа прямо пропорциональна его давлению над жидкостью.
Способы выражения концентрации растворов. Концентрация растворов определяется количеством вещества, заключенным в определенном объеме (или определенной массе) раствора или растворителя в зависимости от того, что выбрано в качестве меры измерения.
Жидкости удобнее измерять по объему, а не по массе, поэтому химики чаще всего используют объемные концентрации, и в первую очередь молярную концентрацию.
Молярная концентрация (молярность) — это число молей растворенного вещества, содержащееся в 1 литре раствора:
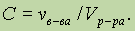
Для различных практических расчетов широко используются также массовые концентрации.
Массовая доля вещества — это отношение массы растворенного вещества к общей массе раствора:
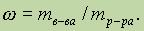
Массовую долю обычно выражают в долях единицы. Не следует смешивать растворимость веществ и массовую долю растворенного вещества.
Растворимость вещества показывает, сколько вещества может раствориться в 100 г растворителя. Единицей растворимости является грамм на 100 г растворителя. Массовая доля растворенного вещества показывает долю этого вещества, содержащуюся в растворе, и является безразмерной величиной.
Иногда массовую долю растворенного вещества выражают не в долях единицы, а в процентах (процентная концентрация).
Растворы электролитов
Ионная проводимость присуща многим химическим соединениям, обладающим ионным строением, например солям в твердом или расплавленном состояниях, а… Электролитическая диссоциация.Кроме хорошей электропроводности, растворы… Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и…Степень диссоциации.Одним из важнейших понятий теории электролитической диссоциации Аррениуса является понятие о степени диссоциации.
Из этого выражения очевидно, что а может изменяться от 0 (диссоциации нет) до…Сильные и слабые электролиты.В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
К сильным электролитам относятся почти все соли, некоторые кислоты (НСl, HBr, HI, НNО3, НсlO4, Н2SO4(разб.)) и некоторые основания (LiОН, NaOH, КОН, Са(ОН)2, Sr(OH)2, Ва(ОН)2). К слабым электролитам относится большинство кислот (особенно органических) и оснований.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор).
Константа диссоциации. Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
A K « A- + K+.
Поскольку диссоциация является обратимым равновесным процессом, то к этой реакцииприменим закон действующих масс, и можно определить константу равновесия как
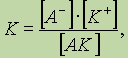
где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.
Диапазон констант равновесия для разных реакций очень большой — от 10-16 до 1015. Например, высокое значение К для реакции
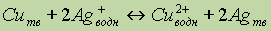
означает, что если в раствор, содержащий ионы серебра Ag+, внести металлическую медь, то в момент достижения равновесия концентрация ионов меди[Cu2+] намного больше, чем квадрат концентрации ионов серебра[Ag+]2.Напротив, низкое значение К в реакции
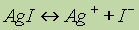
говорит о том, что к моменту достижения равновесия растворилось ничтожно малое количество иодида серебра AgI.
Обратите особое внимание на форму записи выражений для константы равновесия.Если концентрации некоторых реагентов существенно не изменяются в процессе реакции, то они не записываются в выражение для константы равновесия(такие константы обозначаются К1).
Так, для реакции меди с серебром неправильным будет выражение
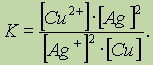
Правильной будет следующая форма записи:
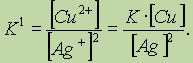
Это объясняется тем, что концентрации металлических меди и серебра введены в константу равновесия. Концентрации меди и серебра определяются их плотностью и не могут быть изменены. Поэтому эти концентрации нет смысла учитывать при расчете константы равновесия.
Аналогично объясняются выражения констант равновесия при растворении AgCl и AgI.
Произведение растворимости.Константы диссоциации малорастворимых солей и гидроксидов металлов называются произведением растворимостисоответствующих веществ (обозначается ПР).
Для реакции диссоциации воды
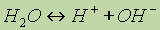
выражение константы будет:
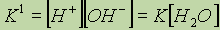 , а не
, а не
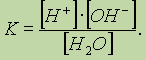
Объясняется это тем, что концентрация воды во время реакций в водных растворах изменяется очень незначительно. Поэтому принимается, что концентрация[Н2О]остается постоянной и вводится в константу равновесия.
Ионные уравнения реакций.Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые ионные уравнения реакций. Написанием ионных уравнений подчеркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода:
1. Образующиеся вещества — сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие на ионы.
2. Одно (или несколько) из образующихся веществ — газ, осадок или слабый электролит (хорошо растворимый в воде).
Рассмотрим две реакции:
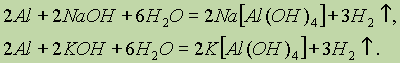
В ионной форме эти уравнения запишутся следующим образом:
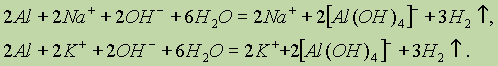
В данном случае алюминий не является электролитом, а молекула воды записывается в недиссоциированной форме потому, что является очень слабым электролитом. Неполярные молекулы водорода практически нерастворимы в воде и удаляются из сферы реакции. Одинаковые ионы в обеих частях уравненийможно сократить, и тогда эти уравнения преобразуются в одно сокращенное ионное уравнение взаимодействия алюминия с щелочами:
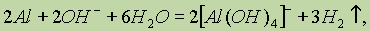
Очевидно, что при взаимодействии алюминия с любой щелочью реакция будет описываться уравнениемСледовательно, ионное уравнение, в отличие от молекулярного, относится не к одной какой-нибудь реакции между конкретными веществами, а к целой группе аналогичных реакций. В этом его большая практическая ценность и значение, например благодаря этому широко используются качественные реакции на различные ионы.
С учетом вышеизложенного можно сформулировать правило, которым удобно руководствоваться при изучении процессов, протекающих в растворах электролитов.
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
Ионное произведение воды.Константа воды . Эту константу для воды называют ионным произведением воды. Ионное произведение воды зависит только от… При диссоциации воды (см. уравнение выше) на каждый ион Н+ образуется один ион…В кислых растворах рН < 7, в нейтральных рН = 7, в щелочных рН > 7.
Основные классы неорганических веществ:
А) Оксиды. Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород.
Согласно международной номенклатуре названия оксидов образуют из латинского корня названия элемента с большей относительной электроотрицательностью… Особую группу кислородных соединений элементов составляют пероксиды. Обычно их… По химическим свойствам оксиды делятся на три группы: основные, кислотные и амфотерные.Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль) и основание (или основная соль), называется гидролизом солей.
Причиной гидролиза является электролитическая диссоциация соответствующих солей и воды. Вода незначительно диссоциирует на ионы Н+ и ОН- , но в процессе гидролиза один или оба из этих ионов могут связываться ионами, образующимися при диссоциации соли, в малодиссоциированные, летучие или труднорастворимые вещества. Рассмотрим гидролиз солей следующих основных типов:
1. Соли сильного основания и сильной кислоты, при растворении в воде (например, NaCI, CaCl2, К2SO4) не гидролизуются, и раствор соли имеет нейтральную реакцию.
2. Соли сильного основания и слабой кислоты, напримерКСlO, Na2CO3, СН3СООNа, NaCN, Na2S, К2SiO3. Запишем уравнение гидролиза ацетата натрия:
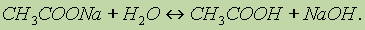
В результате реакции образовался слабый электролит — уксусная кислота. В ионном виде этот процесс можно записать так:
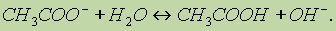
Следовательно, раствор СН3СООNа будет проявлять щелочную реакцию.
При растворении солей многоосновных кислот гидролиз протекает ступенчато, например:
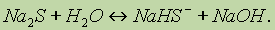
или в ионной форме
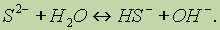
Этот процессотражает гидролиз Na2S по первой ступени. Чтобы гидролиз прошел полностью, как правило, увеличивают температуру процесса:
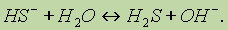
Таким образом, при растворении в воде соли сильного основания и слабой кислоты раствор приобретает щелочную реакцию вследствие гидролиза.
3. Соли слабого основания и сильной кислоты, например Аl2(SO4)3, FeCl2, CuBr2, NH4Cl.
Рассмотрим гидролиз хлорида железа(II):
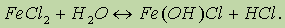
В ионном виде этот процесс можно записать так:
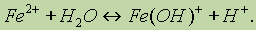
По второй ступени гидролиз протекает следующим образом:
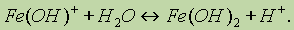
Из приведенных реакций ясно, что в результате гидролиза солей слабого основания и сильной кислоты раствор приобретает кислую реакцию.
4. Соли слабого основания и слабой кислоты, например Al2S3, Сr2S3, СНзСООNН4, (NH4)CO3. При растворении в воде таких солей образуются малодиссоциирующие кислота и основание:
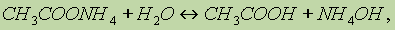
или в ионном виде:
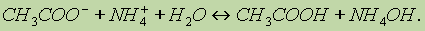
Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. Другими словами, водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований.
Так, при гидролизе СН3СООNН4 реакция раствора будет слабощелочной, поскольку константа диссоциации гидроксида аммония (К = 6,3× 10- 5) больше константы диссоциации уксусной кислоты (К = 1,75× 10- 5).
Протонные кислоты.Электролитическая диссоциация явилась основой успешного развития теории растворов и изучения процессов, протекающих в них. В этом заключается ее большое значение в химии. Однако эта теория не объясняет процессов, протекающих в неводных растворах. Так, например, если хлорид аммония в водном растворе ведет себя как соль (диссоциирует на ионы NН4+ и Сl- ), то в жидком аммиаке он проявляет свойства кислоты, — растворяет металлы с выделением водорода. Как основание ведет себя азотная кислота, растворенная в жидком фтороводороде или в безводной серной кислоте. Эти факты не согласуются с теорией электролитической диссоциации. Их объясняет протолитическая теория кислот и оснований, предложенная в 1923 г. независимо датским ученым Бренстедом и английским ученым Лоури. Согласно этой теории кислотами являются вещества, молекулы или ионы, отщепляющие при данной реакции протоны. Основаниями являются вещества, молекулы или ионы, присоединяющие протоны. Как те, так и другие получили общее название протолитов.
Реакция отщепления протона изображается уравнением:
кислота « основание + Н+
Кислота и основание такого процесса называется сопряженными. Это кислотно-основная пара. Например, ион H3О+ — кислота, сопряженная основанию H2O, а хлорид-ион Cl- — основание, сопряженное кислоте HCI.
Свободные протоны в растворах самостоятельно не существуют. Они переходят от кислоты к какому-либо основанию. Поэтому в растворе всегда протекают два процесса:
кислота1 « основание1 + Н+
основание2 + Н+ « кислота2
и равновесие между ними изображают уравнением
кислота1 + основание2 « основание1 + кислота2
Например, реакцию нейтрализации уксусной кислоты аммиаком можно представить так:
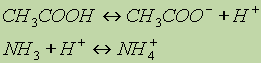
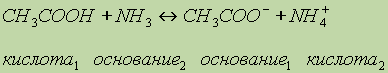
Здесь уксусная кислота является кислотой (отдает протоны Н+), аммиак — основанием (принимает протоны), ионы СН3СОО- играют роль основания (в этом обратимом процессе они могут принять протоны и превратиться обратно в уксусную кислоту), а ионы аммония NH4+ играют роль кислоты (могут отдать протоны).
Аналогично можно изобразить проявление основных свойств азотной кислоты, растворенной в жидком фтороводороде:
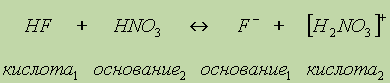
Таким образом, из кислоты и основания всегда получаются новые сопряженные кислота и основание. Протолитическая теория рассматривает реакцию нейтрализации как переход протона кислоты к основанию.
Протолитическая теория расширила круг кислот и оснований по сравнению с представлениями теории электролитической диссоциации: ими могут быть и ионы. Одно и то же вещество а зависимости от того, с чем оно реагирует, может быть или кислотой, или основанием. Теория вскрыла относительность понятий о кислотах и основаниях и показала, что продукты их взаимодействия следует рассматривать как новые кислоты и основания. Протолитическая теория является современной и более общей теорией кислот и оснований.
Кислоты Льюиса.Еще более общее определение кислот и оснований предложил Г. Льюис. Он предположил, что кислотно-основные взаимодействия совсем необязательно происходят с переносом протона. В определении кислот и оснований по Льюису основная роль отводится участию электронных пар в химическом взаимодействии.
Катионы, анионы или нейтральные молекулы, способные принять одну или несколько пар электронов, называют кислотами Льюиса.
AlF3 + : NH3 « [AlF3]: [NH3] Катионы, анионы или нейтральные молекулы, способные отдавать электронные пары,… Так, согласно определению, аммиак является основанием Льюиса в реакцииКомплексообразование
Лигандами могут быть ионы или нейтральные молекулы, определенным образом расположенные вокруг центрального атома. Лиганды характеризуются наличием:… В качестве донорных центров чаще всего выступают элементы главных подгрупп:… К монодентатным лигандам относятся галогенид-ионы, друхатомные молекулы O2, N2, а также ряд сложных ароматических…Классификация комплексных соединений.
- По заряду комплексного иона:
а) катионные:  - гексаамминокобальта (III) хлорид.
- гексаамминокобальта (III) хлорид.
 - гексааквахрома (III) хлорид.
- гексааквахрома (III) хлорид.
б) анионные: 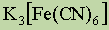 - калия гексацианоферрат (III).
- калия гексацианоферрат (III).
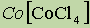 -кобальта тетрахлоркобальтат (II).
-кобальта тетрахлоркобальтат (II).
в)нейтральные комплексы:
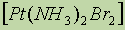 - дибромдиамминплатина (II).
- дибромдиамминплатина (II).
- По природе лиганда:
а) с нейтральными лигандами: 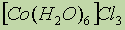 - гексааквакобальта (III) хлорид.
- гексааквакобальта (III) хлорид.
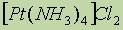 - тетраамминоплатины (III) хлорид.
- тетраамминоплатины (III) хлорид.
б) ацидокомплексы: 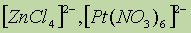 - тетра- и, соответственно, гекса-.
- тетра- и, соответственно, гекса-.
в) гетеролигандные: 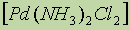 - дихлордиамминпалладий (II).
- дихлордиамминпалладий (II).
Номенклатура (IUPAC).
- дибромдиамминплатина (II). - калий гексафтороалюминат. - гексаамминокобальта (III) хлорид.Координационное число. Координационным числом (к. ч.)– обычно называют то количество лигандов, которое центральный атом координирует в денном комплексном соединении.
Так, например в вышеприведенных примерах к. ч. соответственно равны: платина (II) – 4, алюминий – 6, кобальт – 6, платина (II) – 4.
Константа устойчивости (образования) комплексов.Если представить схематично образование комплексного соединения реакцией
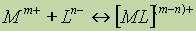 , то
, то
константа образования (устойчивости) комплексного соединения запишется следующим образом:
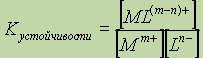 , где
, где
[Mm+] и [Ln-] концентации металла и лиганда соответственно, а [ML(m-n)+]- концентрация образующегося комплексного соединения. Константа образования – величина всегда положительная.
Если комплексообразование протекает ступенчато, как, например, в случае:
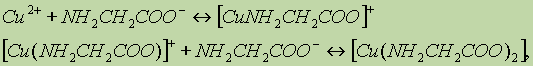
то для каждой стадии комплексообразования записывается своя ступенчатая константа устойчивости:
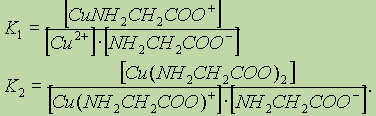
Общая константа устойчивости:
B = К1× К2.
Ввиду того, что константы образования – величины, как правило, малые, удобно пользоваться логарифмами констант:
Log b = log К1 + log К2.
По тем же причинам чаще пользуются константой нестойкости комплексного соединения:
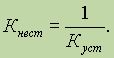
Константа нестойкости – величина отрицательная, следовательно, чем меньше 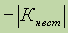 , тем утойчивее комплекс.
, тем утойчивее комплекс.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции в растворах.
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окисление — это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдает свои электроны, то он приобретает положительный заряд:
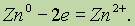
Если отрицательно заряженный ион (заряд -1), например Сl- , отдает 1 электрон, то он становится нейтральным атомом:
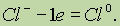
Если положительно заряженный ион или атом отдает электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
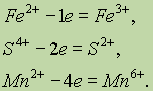
Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.
Если атом присоединяет электроны,то он превращается в отрицательно заряженный ион:
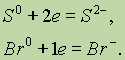
Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается:
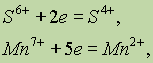
или он может перейти в нейтральный атом:
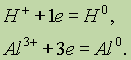
Окислителемявляется атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны.
Окислительв процессе реакции восстанавливается, восстановитель — окисляется.
Однако для составления уравнений окислительно-восстановительных реакций не имеет существенного значения, какая связь при этом образуется — ионная… Определение стехиометрических коэффициентов в уравнениях… В качестве примера составления уравнений окислительно-восстановительных реакций рассмотрим процесс окисления пирита…Химические процессы, сопровождающиеся возникновением электрического тока или вызываемые им, называются электрохимическими.
Благодаря электростатическому притяжению катионов раствора и избыточных электронов металла на границе раздела фаз возникает так называемый двойной… или с учетом гидратации ионов в растворе:Электролиз растворов. Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.
На катоде источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является “восстановителем”. На аноде происходит отдача электронов анионами, поэтому анод является “окислителем”.
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
на аноде — окисление анионов и гидроксид-ионов,
на катоде — восстановление катионов и ионов водорода.
При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими реакциями на электродах являются:
на аноде — окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода;
на катоде — восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода.
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного процесса на аноде и катоде при электролизе растворов солей с инертным электродом используют следующие правила:
1. На аноде могут образовываться следующие продукты: а) при электролизе растворов, содержащих в своем составе анионы F- , SO42- , NО3- , РО43- , а также растворов щелочей выделяется кислород; б) при окислении анионов Сl- , Вr- , I- выделяются соответственно хлор, бром, иод; в) при окислении анионов органических кислот происходит процесс:
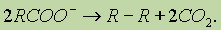
2. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl3+, на катоде выделяется водород; если ион расположен в ряду напряжений правее водорода, то на катоде выделяется металл.
3. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al+ и Н+, на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода.
Рассмотрим в качестве примера электролиз водного раствора хлорида меди на инертных электродах. В растворе находятся ионы Си2+ и 2Сl- , которые под действием электрического тока направляются к соответствующим электродам:
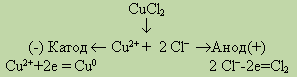
На катоде выделяется металлическая медь, на аноде — газообразный хлор.
Если в рассмотренном примере электролиза раствора CuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl- и выделения хлора протекает окисление анода (меди). В этом случае происходит растворение самого анода, и в виде ионов Си он переходит в раствор. Электролиз CuCl2 с растворимым анодом можно записать так:
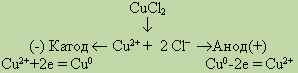
Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
Электролиз расплавов.Для получения высокоактивных металлов (натрия, алюминия, магния, кальция и др.), легко вступающих во взаимодействие с водой, применяют электролиз расплава солей или оксидов:
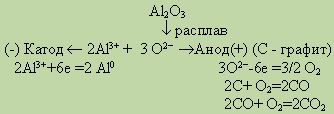
Если пропускать электрический ток через водный раствор соли активного металла и кислородсодержащей кислоты, то ни катионы металла, ни ионы кислотного остатка не разряжаются. На катоде выделяется водород,а нааноде — кислород, и электролиз сводится к электролитическому разложению воды.
Электролиз растворов электролитов проводить энергетически выгоднее, чем расплавов, так как электролиты — соли и щелочи — плавятся при очень высоких температурах.
Закон электролиза Фарадея.Зависимость количества вещества, образовавшегося под действием электрического тока, от времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фарадея:
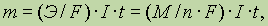
где т — масса образовавшегося при электролизе вещества (г); Э — эквивалентная масса вещества (г/моль); М — молярная масса вещества (г/моль); п — количество отдаваемых или принимаемых электронов; I — сила тока(А); t — продолжительность процесса(с); F — константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества (F = 96 500 Кл/моль = 26,8 А×ч/моль).
НЕОРГАНИЧЕСКАЯ ХИМИЯ. ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
Водород
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного… Атом водорода состоит из одного протона и одного электрона. Этот простейший… Таким образом, водород имеет двойственную природу, проявляя как окислительную, так и восстановительную способность. По…Галогены
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с… Электронные конфигурации внешнего валентного слоя галогенов относятся к типу… При обычных условиях галогены существуют в виде простых веществ, состоящих из двухатомных молекул типа Hal2 с…Кислород
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного… Кислород в природе имеет три устойчивых изотопа: 16О, 17О и 18О. В свободном… Как известно, аллотропия — способность химического элемента существовать в виде двух или нескольких простых веществ,…Сера
Свойства 16S.
| Атомная масса | 32,06 | кларк, ат.% (распространненость в природе) | 0,03 |
| Электронная конфигурация* | 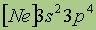
| Агрегатное состояние (н. у.). | твердое вещество |
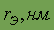
| 0,127 | Цвет | желтый |
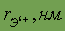
| (0,029) | 
| 119,30 |
Энергия ионизации
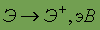
| 10,357 | 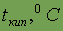
| 444,6 |
| Относительная электроотрицательность | 2,5 | Плотность 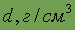
| 2,07 |
| Возможные степени окисления | -2,+1,+2, +3, +4,+6 | Стандартный электродный потенциал
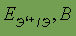
| - 0,44 |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Нахождение в природе. Сера широко распространена в природе. Она составляет 0,05% массы земной коры. В свободном состоянии (самородная сера) в больших количествах встречается в Италии (острова Сицилия) и США. Месторождения самородной серы имеются в Поволжье, в государствах Средней Азии, в Крыму и других районах.
Сера часто встречается в виде соединений с другими элементами. Важнейшими ее природными соединениями являются сульфиды металлов: FeS2 — железный колчедан, или пирит; ZnS — цинковая обманка; PbS — свинцовый блеск; HgS — киноварь и др., атакжесоли серной кислоты (кристаллогидраты): СаSO4× 2Н2O — гипс,Na2SO4 × 10H2O — глауберова соль, МgSО4 × 7H2O — горькая соль и др.
Сера содержится в организмах животных и растений, так как входит в состав белковых молекул. Органические соединения серы содержатся в нефти.
Физические свойства.Сера — твердое хрупкое вещество желтого цвета. В воде практически нерастворима, но хорошо растворяется в сероуглероде, анилине и некоторых других растворителях. Плохо проводит теплоту и электричество. Сера образует несколько аллотропных модификаций — сера ромбическая, моноклинная, пластическая. Наиболее устойчивой модификацией является ромбическая сера, в нее самопроизвольно через некоторое время превращаются все остальные модификации.
При 444,6 °С сера кипит, образуя пары темно-бурого цвета. Если их быстро охладить, то получается тонкий порошок, состоящий из мельчайших кристаллов серы, называемый серным цветом.
Природная сера состоит из смеси четырех устойчивых изотопов: 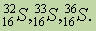
Химические свойства.Сера может отдавать свои электроны при взаимодействии с более сильными окислителями:
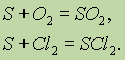
В этих реакциях сера является восстановителем. Нужно подчеркнуть, что оксид серы (VI) может образовываться только в присутствии Pt или V2O5 и высоком давлении.
При взаимодействии с металлами сера проявляет окислительные свойства:
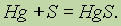
С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре. Это обстоятельство используется в лабораториях для удаления разлитой ртути, пары которой являются сильным ядом.
Применение. Сера широко применяется в промышленности и сельском хозяйстве. Около половины ее добычи расходуется для получения серной кислоты. Используют серу для вулканизации каучука: каучук приобретает повышенную прочность и упругость. В виде серного цвета (тонкого порошка) сера применяется для борьбы с болезнями виноградника и хлопчатника. Она употребляется для получения пороха, спичек, светящихся составов. В медицине приготовляют, серные мази для лечения кожных заболеваний.
Сероводород, сероводородная кислота, сульфиды.При нагревании серы с водородом происходит обратимая реакция:
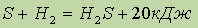
с очень малым выходом сероводорода H2S. Обычно Н2S получают действием разбавленных кислот на сульфиды:
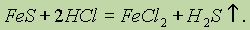
Эту реакцию часто проводят в аппарате Киппа.
Физические свойства.Сероводород Н2S — бесцветный газ с запахом тухлых яиц, ядовит. Один объем воды при обычных условиях растворяет 3 объема сероводорода.Сероводород — очень ядовитый газ, поражающий нервную систему. Поэтому работать с ним надо в вытяжных шкафах или с герметически закрывающимися приборами. Допустимое содержание H2S в производственных помещениях составляет 0,01 мг в 1 л воздуха.
Раствор сероводорода а воде называется сероводородной водой или сероводородной кислотой (она обнаруживает свойства слабой кислоты).
Химические свойства.Сероводород — типичный восстановитель. В кислороде он сгорает. Раствор сероводорода в воде представляет собой очень слабую сероводородную кислоту, которая диссоциирует ступенчато и в основном по первой ступени:
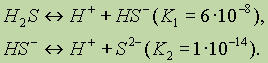
Сероводородная кислота, так же как и сероводород, — типичный восстановитель.
Сероводородная кислота окисляется не только сильными окислителями, например хлором,
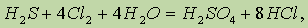
но и более слабыми, например сернистой кислотой H2SO3:
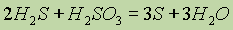
или ионами трехвалентного железа:
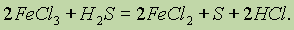
Сероводородная кислота может реагировать с основаниями, основными оксидами или солями, образуя два ряда солей: средние — сульфиды, кислые — гидросулъфиды. Большинство сульфидов (за исключением сульфидов щелочных и щелочноземельных металлов, а также сульфида аммония) плохо растворимо в воде. Сульфиды,каксоли очень слабой кислоты, подвергаются гидролизу.
Нахождение в природе. Сероводород встречается в природе в вулканических газах и В водах некоторых минеральных источников, например Пятигорска, Мацесты. Он образуется при гниении серосодержащих органических веществ различных растительных и животных остатков. Этим объясняется характерный неприятный запах сточных вод, выгребных ям и свалок мусора.
Сульфиды. Например, Na2S — сульфид натрия, NaHS — гидросульфид натрия.
Гидросульфиды почти все хорошо растворимы в воде. Сульфиды щелочных и щелочно-земельных металлов также растворимы в воде, а остальных металлов практически нерастворимы или мало растворимы; некоторые из них не растворяются и в разбавленных кислотах. Поэтому такие сульфиды можно легко получить, пропускаясероводород через соли соответствующего металла, например:
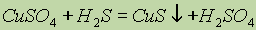
Некоторые сульфиды имеют характерную окраску: CuS и PbS— черную, CdS — желтую, ZnS— белую, MnS — розовую, SnS — коричневую, Sb2S3— оранжевую и т. д. На различной растворимоcти сульфидов и различной окраске многих из них основан качественный анализ катионов.
Оксид серы (IV).Оксид серы (IV), или сернистый газ, при обычных условиях — бесцветный газ с резким, удушливым запахом. При охлаждении до -10° С сжижается в бесцветную жидкость. В жидком виде его хранят в стальных баллонах.
SO2 образуется при сжигании серы в кислороде или при обжиге сульфидов. Он хорошо растворим в воде (40 объемов в 1 объеме воды при 20 °С).
Получение.В лаборатории оксид серы (IV) получают взаимодействием гидросульфита натрия с серной кислотой:
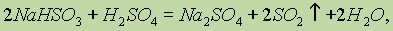
а также нагреванием меди с концентрированной серной кислотой:

Оксид серы (IV) образуется также при сжигании серы.
В промышленных условиях SO2 получают при обжиге пирита FeS2 или сернистых руд цветных металлов (цинковой обманки ZnS, свинцового блеска PbS и др.). Образующийся в этих условиях оксид серы (IV) SO2 употребляется главным образом для получения оксида серы (VI) SO3 и серной кислоты. Структурная формула молекулы SO2:
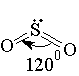
Как видим, в образовании связей в молекуле SO2 принимают участие четыре электрона серы и четыре электрона от двух атомов кислорода. Взаимное отталкивание связывающих электронных пар и неподеленной электронной пары атома серы придает молекуле угловую форму.
Оксид серы (IV) проявляет все свойства кислотных оксидов.
Сернистая кислота. Оксид серы (IV) — ангидрид сернистой кислоты H2SO3 , поэтому при растворении SO2 в воде частично происходит реакция с водой и образуется слабая сернистая кислота:
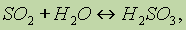
которая малоустойчива, легко распадается вновь на SO2 и Н2О. В водном растворе сернистого газа одновременно существуют следующие равновесия:
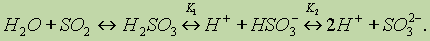
Константа диссоциации H2SO3 по первой ступени равна K1 = 1,6× 10-2, по второй — K2 = 6,3× 10-8. Являясь двухосновной кислотой, она дает два ряда солей: средние — сульфиты и кислые — гидросульфиты.
Сульфиты образуются при полной нейтрализации кислоты щелочью:
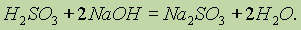
Гидросульфиты получаются при недостатке щелочи (по сравнению с количеством, необходимым для полной нейтрализации кислоты):
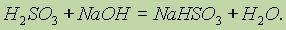
Как и оксид серы (IV), сернистая кислота и ее соли являются сильными восстановителями. При этом степень окисления серы возрастает. Так, H2SO3 легко окисляется в серную кислоту даже кислородом воздуха:
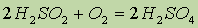
Поэтому долго хранившиеся растворы сернистой кислоты всегда содержат серную кислоту.
Еще легче протекает окисление сернистой кислоты бромом и перманганатом калия:
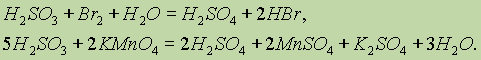
Химические реакции, характерные для SO2, сернистой кислоты и ее солей, можно разделить на три группы:
1. Реакции, протекающие без изменения степени окисления, например:
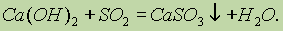
2. Реакции, сопровождающиеся повышением степени окисления серы от 4+ до 6+:
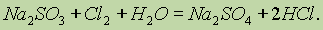
3. Реакции, протекающие с понижением степени окисления серы, например уже отмеченное выше взаимодействие SO2 с H2S.
Таким образом, SO2, сернистая кислота и ее соли могут проявлять как окислительные, так и восстановительные свойства.
Применение.Оксид серы (IV) и сернистая кислота обесцвечивают многие красители, образуя с ними бесцветные соединения. Последние могут снова разлагаться при нагревании или на свету, в результате чего окраска восстанавливается. Следовательно, белящее действие SO2 и H2SO3 отличается от белящего действия хлора. Обычно оксидом серы (IV) белят шерсть, шелк и солому (хлорной водой эти материалы разрушаются).
Оксид серы (IV) убивает многие микроорганизмы. Поэтому для уничтожения плесневых грибков им окуривают сырые подвалы, погреба, винные бочки и др. Используют также при перевозке и хранении фруктов и ягод. В больших количествах оксид серы (IV) используется для получения серной кислоты.
Важное применение находит раствор гидросульфита кальция Са(НSO3)2 (сульфитный щелок), которым обрабатывают волокна древесины и бумажную массу.
Оксид серы (VI).SO3 — ангидрид серной кислоты — вещество с tпл= 16,8 °С и tкип= 44,8 °С. Оксид серы (VI), или триоксид серы, — это бесцветная жидкость, затвердевающая при температуре ниже 17° С в твердую кристаллическую массу. Оксид серы (VI) обладает всеми свойствами кислотных оксидов. Он является промежуточным продуктом производства серной кислоты.
Оксид серы (VI) получают окислением SO2 кислородом только в присутствии катализатора:

Необходимость использования катализатора в этой обратимой реакции обусловлена тем, что хороший выход SO3 (т. е. смещение равновесия вправо) можно получить только при понижении температуры, однако при низких температурах очень сильно падает скорость протекания реакции.
Молекула SO3 имеет форму треугольника, в центре которого находится атом серы:
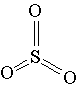
Такое строение обусловлено взаимным отталкиванием связывающих электронных пар. На их образование атом серы предоставил все шесть внешних электронов.
Серная кислота. Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту:
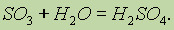
SO3 очень хорошо растворяется в 100%-ной серной кислоте. Раствор 80з в такой кислоте называется олеумом.
Физические свойства. Серная кислота — тяжелая бесцветная маслянистая жидкость. Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты, поэтомунельзя воду приливать к концентрированной кислоте — произойдет разбрызгивание кислоты. Для разбавления надосерную кислоту приливать небольшими количествами к воде.
Безводная серная кислота растворяет до 70% оксида серы (VI). При обычной температуре она не летуча и не имеет запаха. При нагревании отщепляет SO3 до тех пор, пока не образуется раствор, содержащий 98,3% Н2SO4. Безводная Н2SO4 почти не проводит электрический ток.
Химические свойства. Концентрированная серная кислота обугливает органические вещества — сахар, бумагу, дерево, волокна и т. д., отнимая от них элементы воды. При этом образуются гидраты серной кислоты. Обугливание сахара можно выразить уравнением
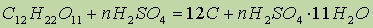
Образовавшийся уголь частично вступает во взаимодействие с кислотой:
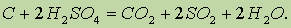
Поэтому кислота, которая идет в продажу, имеет бурый цвет от случайно попавших и обуглившихся в ней пыли и органических веществ.
На поглощении (отнятии) воды серной кислотой основана осушка газов.
Как сильная нелетучая кислота H2SO4 вытесняет другие кислоты из сухих солей:
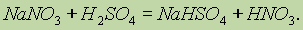
Однако если Н2SO4 добавляется к растворам солей, то вытеснения кислот не происходит.
При взаимодействии концентрированной серной кислоты с различными металлами, как правило, происходит ее восстановление до SO2:
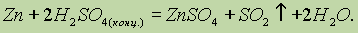
Концентрированная серная кислота окисляет медь, серебро, углерод, фосфор:
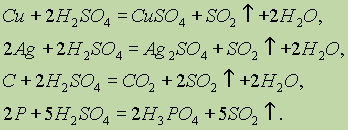
Разбавленная серная кислота окисляет только металлы, стоящие в ряду напряжений левее водорода, за счет ионов Н+:
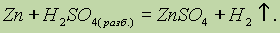
Из всех сульфатов наименьшей растворимостью обладает сульфат бария — именно поэтому его образование в виде белого осадка используют как качественную реакцию на сульфат-ион:
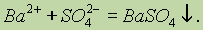
Значение серной кислоты. Серная кислота является важнейшим продуктом основной химической промышленности, занимающейся производством неорганических кислот, щелочей, солей минеральных удобрений и хлора.
По разнообразию применения серная кислота занимает первое место среди кислот. Наибольшее количество ее расходуется для получения фосфорных и азотных удобрений. Будучи нелетучей кислотой, серная кислота используется для получения других кислот — соляной, плавиковой, фосфорной, уксусной и т. д. Много ее идет для очистки нефтепродуктов — бензина, керосина и смазочных масел — от вредных примесей. В машиностроении серной кислотой очищают поверхность металла от оксидов перед покрытием (никелированием, хромированием и др.). Серная кислота применяется в производстве взрывчатых веществ, искусственного волокна, красителей, пластмасс и многих других. Ее употребляют для заливки аккумуляторов. В сельском хозяйстве она используется для борьбы с сорняками (гербицид).
Соли серной кислоты.Серная кислота, будучи двухосновной, образует два ряда солей: средние, называемые сульфатами, и кислые, называемые гидросульфатами. Сульфаты образуются при полной нейтрализации кислоты щелочью (на один моль кислоты приходится два моля щелочи), а гидросульфаты — при недостатке щелочи (на один моль кислоты — один моль щелочи):
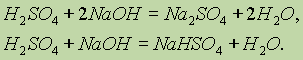
Многие соли серной кислоты имеют большое практическое значение.
Азот
Свойства 7N.
| Атомная масса | 14,006 | кларк, ат.% (распространненость в природе) | 0,03 |
| Электронная конфигурация* | 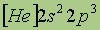
| Агрегатное состояние (н. у.). | газ |
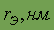
| 0,071 | Цвет | бесцветный |
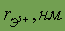
| 0,015 | 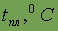
| -210,01 |
Энергия ионизации
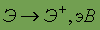
| 14,53 | 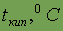
| -195,81 |
| Относительная электро- отрицательность | 3,0 | Плотность 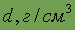
| 0,879 |
| Возможные степени окисления | -3 ¸ +5 | Стандартный электродный потенциал
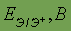
| ¾ |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Нахождение в природе.Азот в природе встречается главным образом в свободном состоянии. В воздухе объемная доля его составляет 78,09%, а массовая доля 75,6%. Соединения азота в небольших количествах содержатся в почвах. Азот входит в состав белковых веществ и многих естественных органических соединений.
Получение. В технике азот получают из жидкого воздуха. Как известно, воздух — это смесь газов, главным образом азота и кислорода. Сухой воздух у поверхности Земли содержит (в объемных долях): азота 78,09%, кислорода 20,95%, благородных газов 0,93%, оксида углерода (IV) 0,03%, а также случайные примеси — пыль, микроорганизмы, сероводород, оксид серы (IV) и др. Для получения азота воздух переводят в жидкое состояние, а затем испарением отделяют азот от менее летучего кислорода (т. кип. азота -195,8° С, кислорода -183° С). Полученный таким образом азот содержит примеси благородных газов (преимущественно аргона). Чистый азот можно получить в лабораторных условиях, разлагая при нагревании нитрит аммония:
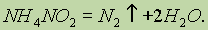
Физические свойства.Азот в свободном состоянии — газ без цвета и запаха, состоящий из двухатомных молекул N2.Он является основным компонентом атмосферы Земли (78% по объему).Азот легче воздуха. Растворимость в воде меньше, чем у кислорода: при 20 °С в 1 л воды растворяется 15,4 мл азота (кислорода 31 мл). Поэтому в воздухе, растворенном в воде, содержание кислорода по отношению к азоту больше, чем в атмосфере. Малая растворимость азота в воде, а также его очень низкая температура кипения объясняются весьма слабыми межмолекулярными взаимодействиями как между молекулами азота и воды, так и между молекулами азота.
Природный азот состоит из двух стабильных изотопов с массовыми числами 14 (99,64%) и 15 (0,36%).
В молекуле N2 атомы связаны тремя ковалентными связями (две p -связи, одна s -связь), поэтому энергия диссоциации этой молекулы чрезвычайно велика:
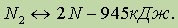
Этим объясняется малая реакционная способность азота при обычной температуре (сравните с О2 и Cl2).
Химические свойства.Для того чтобы азот вступил в химическую реакцию, требуется предварительная активация его молекул нагреванием, облучением или другими способами.
Из металлов азот реагирует в обычных условиях только с литием, образуя нитрид:
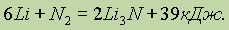
С другими металлами он реагирует лишь при высоких температурах, образуя нитриды. С натрием, кальцием и магнием реакция идет только при нагревании:
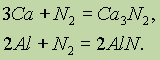
Образующиеся нитриды полностью гидролизуются при контакте с водой:
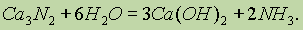
С кислородом азот взаимодействует только в электрической дуге (3000-4000° С) (например, при грозовом разряде в атмосфере) или при очень сильном нагревании:
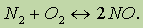
Поскольку на внешнем энергетическом уровне атома азота находится 5 электронов, азот проявляет степени окисления -3 и +5, а также +4, +3, +2, +1, -1 и -2.
Применение. В больших количествах азот употребляется для получения аммиака. Широко используется для создания инертной среды — наполнение электрических ламп накаливания и свободного пространства в ртутных термометрах, при перекачке горючих жидкостей. Им азотируют поверхность стальных изделий, т. е. насыщают их поверхность азотом при высокой температуре. В результате в поверхностном слое образуются нитриды железа, которые придают стали большую твердость. Такая сталь выдерживает нагревание до 500 °С без потери своей твердости.
Важное значение азот имеет для жизни растений и животных, поскольку он входит в состав белковых веществ. Соединения азота находят применение в производстве минеральных удобрений, взрывчатых веществ и во многих отраслях промышленности.
Аммиак.В огромных количествах азот используется для синтеза аммиака.
Реакция с водородом идет при нагревании (хотя процесс и экзотермический!) и очень высоком давлении и обязательно с катализатором:
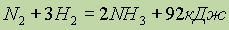
Физические свойства.Аммиак — важнейшее соединение азота. В обычных условиях это — бесцветный газ, легче воздуха, с резким запахом. Аммиак сжижается при -33,35 °С и затвердевает при -77,7 °С.
Молекула аммиака имеет форму пирамиды, в основании которой лежит треугольник из атомов водорода, а в вершине — атом азота, в жидком аммиаке молекулы NH3 связаны между собой водородными связями, обусловливая тем самым аномально высокую температуру кипения. Полярные молекулы NH3 очень хорошо растворимы в воде (700 объемов NH3 в одном объеме H2O).
Электронная формула молекулы аммиака такова:
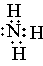
Видно, что из четырех электронных пар при азоте три общие (связывающие) и одна неподеленная (несвязывающая).
Химическая связь N—Н полярная: положительный заряд сосредоточен на атомах водорода, отрицательный — на атоме азота. Вследствие этого между молекулами аммиака и образуется водородная связь, что можно изобразить так:
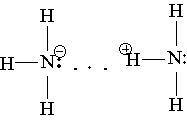
Благодаря водородным связям аммиак имеет сравнительно высокие температуры плавления и кипения, а также высокую теплоту испарения, он легко сжижается.
Раствор аммиака в воде представляет собой раствор гидроксида аммония, содержащий одновременно молекулярные частицы NH3 и NH4OH и ионы NH4+ и ОН- :
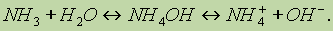
Водный раствор аммиака обладает свойствами слабого основания, константа его диссоциации при 25 °С составляет 1,8 × 10-5.
Азот в аммиаке имеет наименьшую степень окисления и поэтому проявляет только восстановительные свойства. Так, например, при горении аммиака образуются азот и вода:
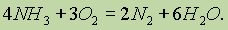
В присутствии катализатора аммиак может окисляться и до оксида азота NО:
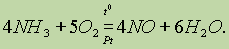
При нагревании аммиака с галогенами, перокcидом водорода, оксидами тяжелых металлов образуется молекулярный азот:
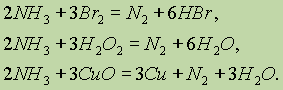
Аммиак идет главным образом на производство азотной кислоты и различных удобрений — нитрата аммония NH4NO3, карбамида (мочевины) (NH2)2CO, аммофоса (смесь гидро- и дигидрофосфатов аммония (NH4)2HPO4 и NH4H2PO4).
Соли аммония.Продукты взаимодействия аммиака с кислотами представляют собой соли аммония:
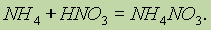
Соли аммония по многим свойствам похожи на соли щелочных металлов, особенно на соли калия и рубидия. Такое сходство объясняется тем, что размер иона аммония (радиус 1,48 А) близок к размерам ионов К+ (1,33 Å) и Rb+ (1,48 Å).
Они проявляют общие свойства солей, т. е. взаимодействуют с растворами щелочей, кислот и других солей:
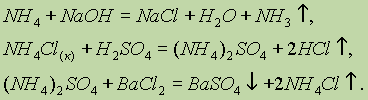
Все аммонийные соли растворимы в воде и при этом гидролизуются. Соли аммония термически неустойчивы и при нагревании разлагаются:
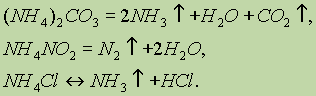

Оксиды азота. В оксидах азота степень его окисления меняется от 1+ до 5+. Оксиды N2O и NO—- бесцветные газы, оксид азота (IV) NO2 — бурый газ, получивший в промышленности название “лисий хвост”. Оксид азота (III) N2O3 — синяя жидкость, оксид азота (V) N2O5 при обычных условиях — прозрачные бесцветные кристаллы.
Оксиды N2O и NO не реагируют c водой и щелочами, тогда как N2O3 и N2O5, являясь ангидридами, при взаимодействии с водой дают соответствующие кислоты:
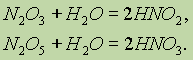
Азотистая кислота.HNO2 неустойчива, тогда как ее соли нитриты, устойчивы.
Оксид азота (IV) NO2 легко подвергается димеризации, уже при незначительном охлаждении образуя жидкость желто-зеленого цвета:
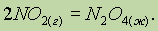
Оксид азота NO2 при растворении в воде обратимо диспропорционирует:
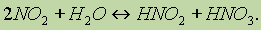
Поскольку образующаяся азотистая кислота неустойчива, то при нагревании реакция идет по-другому:
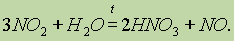
Если диоксид азота NO2 растворяют в воде в присутствии кислорода, то получают только азотную кислоту:
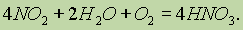
Последнюю реакцию используют в промышленности для получения азотной кислоты.
Азотная кислота. НNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом, очень гигроскопична, “дымит” на воздухе. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде.
Химические свойства. Под действием света азотная кислота частично разлагается с выделением NО2 и за счет этого приобретает светло-бурый цвет:
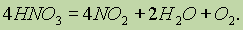
Азотная кислота принадлежит к числу наиболее сильных кислот, и для нее характерны все реакции, в которые вступают кислоты, — с основаниями, основными оксидами и т. д.
Специфическим свойством азотной кислоты является ее ярко выраженная окислительная способность. Сущность окисления различных веществ азотной кислотой заключается в том, что ион NO3- , имеющий в своем составе азот в степени окисления 5+, в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) может принимать от одного до восьми электронов. Восстановление аниона NO3- в связи с этим может протекать до различных веществ:
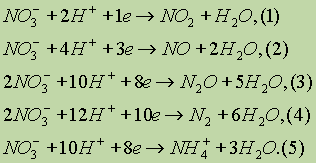
Какое из этих веществ образуется, т. е. насколько глубоко произошло восстановление азотной кислоты, в каждом конкретном случае зависит от природы восстановителя, от условий протекания реакции и от концентрации самой кислоты.
При прочих равных условиях образование тех или иных продуктов восстановления азотной кислоты зависит от концентрации. Азотная кислота обладает окислительной способностью при любой концентрации, при этом, однако, чем концентрированнее HNO3, тем менее глубоко она восстанавливается.
С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме(1) с выделением NO2; если HNO3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2—5), в зависимости от степени разбавления.
Чтобы восстановление HNO3 провести наиболее глубоко, необходимо использовать максимально разбавленную кислоту, применять сильный восстановитель и реакцию вести на холоде. При использовании более концентрированной кислоты низшие оксиды азота (образованные в ходе реакции) окисляются концентрированной кислотой до высших.
Азотная кислота взаимодействует со всеми металлами, за исключением Au, Pt, W. Концентрированная HNO3 не взаимодействует при обычных условиях также с Fe, Al и Сr, которые она пассивирует, однако при очень сильном нагревании HNO3 взаимодействует и с этими металлами.
Большинство неметаллов и сложных веществ восстанавливают HNO3, как правило, до NO (реже до NO2):
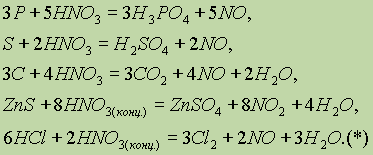
Азотная кислота окисляет при нагревании даже кремний:
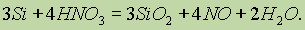
Однако полного растворения образца кремния при этом не происходит, так как, едва начавшись, последняя реакция быстро прекращается, поскольку образующийся на поверхности кристаллический SiO2 (кислотный оксид с высшей степенью окисления кремния) препятствует дальнейшему протеканию реакции.
Если же взять смесь азотной и плавиковой кислот, то при нагревании происходит полное растворение образца кремния:
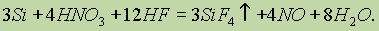
С помощью концентрированной HNO3 можно растворить также и золото. Для этого необходимо взять смесь, состоящую из одного объема концентрированной HNO3 и трех объемов концентрированной соляной кислоты (такую смесь называют царской водкой):
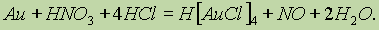
Действие царской водки объясняется тем, что концентрированная HNO3 окисляет НСl по реакции (*) до свободного хлора, который в момент выделения является очень сильным окислителем. По этой причине при растворении металлов в царской водке никогда не получаются соли азотной кислоты, а получаются соответствующие хлориды.
Разложение нитратов. При нагревании твердых нитратов практически все они разлагаются с выделением кислорода (единственным исключением является нитрат аммония), при этом все нитраты можно разделить на четыре группы.
Первую группу составляют нитраты щелочных металлов, которые при нагревании разлагаются на нитриты и кислород, например:
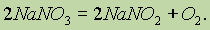
Вторую группу составляет большинство нитратов менее активных металлов (от щелочноземельных металлов до меди включительно), которые разлагаются на оксид металла, NO2 и кислород:

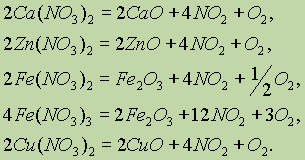
Третью группу составляют нитраты наиболее тяжелых металлов, разлагающиеся до свободного металла, NO2 и кислорода:
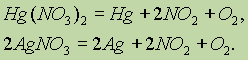
Четвертую группу составляет нитрат аммония.
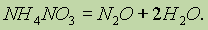
Азотистая кислота. HNО2 принадлежит к слабым кислотам (К = 6×10-4 при 25 °С), она лишь немного сильнее уксусной. Азотистая кислота неустойчива и известна только в разбавленных растворах, в которых осуществляется равновесие
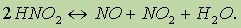
Нитриты, в отличие от самой кислоты, устойчивы даже при нагревании. Исключением является кристаллический нитрит аммония, который при нагревании разлагается на свободный азот и воду:
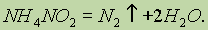
Применение.Большие количества азотной кислоты расходуются на приготовление азотных удобрений, взрывчатых и лекарственных веществ, красителей пластмасс, искусственных волокон и др. материалов. Дымящая азотная кислота применяется в ракетной технике в качестве окислителя ракетного топлива.
Фосфор
Свойства 15P.
| Атомная масса | 30,97 | кларк, ат.% (распространненость в природе) | 0,04 |
| Электронная конфигурация* | 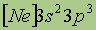
| Агрегатное состояние (н. у.). | твердое вещество |
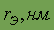
| 0,013 | Цвет | белый красный черный |
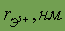
| 0,035 | 
| 44,2 |
Энергия ионизации
| 10,484 | 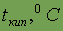
| |
| Относительная электроотрицательность | 2,1 | Плотность 
| бел. – 1,82 красн. – 2,69 черн. – 2,2 |
| Возможные степени окисления | -3, +3, +4, +5 | Стандартный электродный потенциал
| ¾ |
*Приведена конфигурация внешних электронных уровней атома элемента. Конфигурация остальных электронных уровней совпадает с таковой для благородного газа, завершающего предыдущий период и указанного в скобках.
Фосфор — аналог азота. Однако по сравнению с атомом азота атом фосфора характеризуется меньшей энергией ионизации и имеет больший радиус. Это означает, что неметаллические признаки у фосфора выражены слабее, чем у азота. Поэтому для фосфора реже встречается степень окисления -3 и чаще +5. Мало характерны и другие степени окисления.
Физические свойства.Фосфор — один из распространенных элементов в земной коре. В свободном состоянии в природе фосфор не встречается из-за высокой химической активности. Уменьшение неметалличности элемента фосфора по сравнению с азотом сказывается на свойствах его простых веществ. Так, фосфор в отличие от азота имеет несколько аллотропных модификаций: белый, красный, черный и др.
Белый фосфор — бесцветное и очень ядовитое вещество. Получается конденсацией паров фосфора. Не растворяется в воде, но хорошо растворяется в сероуглероде. При длительном слабом нагревании белый фосфор переходит в красный.
Красный фосфор — порошок красно-бурого цвета, не ядовит. Нерастворим в воде и сероуглероде. Установлено, что красный фосфор представляет собой смесь нескольких аллотропных модификаций, которые отличаются друг от друга цветом (от алого до фиолетового) и некоторыми другими свойствами. Свойства красного фосфора во многом зависят от условий его получения.
Черный фосфор по внешнему виду похож на графит, жирный на ощупь, обладает полупроводниковыми свойствами. Получается длительным нагреванием белого фосфора при очень большом давлении (200° С и 1200 МПа).
Красный и черный фосфор при сильном нагревании возгоняются.
Природный фосфор состоит из одного стабильного изотопа 3115P. Широкое применение нашел искусственный радиоактивный изотоп 3215P (период полураспада 14,3 суток).
Свойства аллотропных модификаций фосфора объясняются их строением. Более подробно изучено строение белого фосфора. Он имеет молекулярную кристаллическую решетку. Его молекулы четырехатомны (P4 — тетрафосфор) и имеют форму правильной трехгранной пирамиды, а каждый атом фосфора находится в
одной из вершин пирамиды и связан тремя s -связями с другими тремя атомами. Как все вещества с молекулярной решеткой, белый фосфор легко плавится и летуч. Он хорошо растворяется в органических растворителях.
В отличие от белого фосфора красный и черный фосфоры имеют атомную кристаллическую решетку. Поэтому они нерастворимы почти во всех растворителях, не летучи и, как уже отмечалось, не ядовиты.
Нахождение в природе.Общее содержание фосфора в земной коре составляет 0,08%. В связанном виде он входит в состав многих минералов, главным образом апатитов 3Ca3(РО4)2× СаF2 и фосфатов Са3(РO4)2. Разновидности апатита слагают осадочные горные породы — фосфориты, фосфор входит также в состав белковых веществ в виде различных соединений. Содержание фосфора в тканях мозга составляет 0,38%, в мышцах - 0,27%.
Самые богатые в мире залежи апатитов находятся близ г. Кировска на Кольском полуострове. Фосфориты широко распространены на Урале, в Поволжье, в Сибири, Казахстане, Эстонии, Белоруси и др. Большие месторождения фосфоритов имеются в Северной Африке, Сирии и США. Фосфор необходим для жизни растений. Поэтому почва всегда должна содержать достаточное количество соединений фосфора.
Получение.Обычно белый фосфор получают из фосфата кальция при нагревании его в смеси с песком и углем в электрической печи без доступа воздуха:
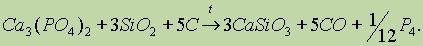
Красный фосфор можно получить при нагревании жидкого белого фосфора без доступа воздуха при температуре около 300 °С при небольшом давлении. При нагревании белого фосфора при большом давлении можно получить и черный фосфор.
Поскольку красный и черный фосфор являются полимерными модификациями, по сравнению с белым у них следует ожидать повышения температур плавления и температур кипения. Действительно, для красного фосфора Тпл составляет 600 °С (под давлением).
Применение.Красный фосфор применяется для производства спичек. Из красного фосфора, сульфида сурьмы (III), железного сурика [природного оксида железа (III) с примесью кварца] и клея приготовляют смесь, которую наносят на боковые поверхности спичечной коробки. Головка спичек состоит главным образом из бертолетовой соли, молотого стекла, серы и клея. При трении головки о намазку спичечной коробки красный фосфор воспламеняется, поджигает состав головки, а от него загорается дерево.
Белый фосфор широкого применения не имеет. Обычно его используют для образования дымовых завес. Черный фосфор применяется очень редко.
Химические свойства.В химическом отношении белый фосфор сильно отличается от красного. Так, белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой. Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240° С. При окислении белый фосфор светится в темноте — происходит непосредственное превращение химической энергии в световую.
В жидком и растворенном состоянии, а также в парах при температуре ниже 800° С фосфор состоит из молекул Р4. При нагревании выше 800° С молекулы диссоциируют: P4 « 2P2. Последние при температуре выше 2000°С распадаются на атомы: P2« 2P. Атомы фосфора могут объединяться в молекулы Р2, Р4 и в полимерные вещества. Очевидно, молекула P4, где атомы связаны между собой тремя s -связями, прочнее молекулы Р2, в которой атомы связаны одной s - и двумя p -связями. Уже при обычной температуре молекула P2.
Фосфор химически активен и непосредственно взаимодействует с большинством простых веществ. Электронная конфигурация внешнего слоя фосфора 3s23p3, поэтому для фосфора наиболее характерны степени окисления 5+ (Н3РO), 3+ (РСl3) и 3- (РН3).
Из трех аллотропных модификаций наиболее активным является белый фосфор. При обычных условиях на воздухе тонко измельченный фосфор самовоспламеняется:
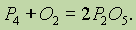
При недостатке кислорода образуется оксид фосфора (III):
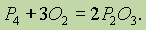
Поскольку температура плавления фосфора мала (44 °С), то давление насыщенных паров фосфора над твердым фосфором при обычных условиях достаточно велико — это и является причиной того, что белый фосфор “светится” в темноте. МолекулыP4 присутствующие в парах над поверхностью, окисляются кислородом с выделением света.
Красный и черный фосфор вступают в химические реакции при более высоких температурах. Аналогично азоту фосфор может взаимодействовать с металлами, образуя фосфиды, например:
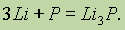
Фосфор соединяется со многими простыми веществами — кислородом, галогенами, серой, проявляя окислительные и восстановительные свойства:
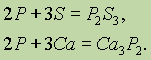
При взаимодействии фосфидов с водой выделяется фосфин РН3:
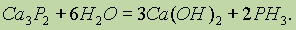
Фосфин. РН3 — чрезвычайно ядовитый газ с чесночным запахом. По своим химическим свойствам он напоминает аммиак, однако, по сравнению с аммиаком является более сильным восстановителем.
По аналогии с NH3 фосфин способен к реакциям присоединения:
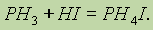
Так, на воздухе фосфин самопроизвольно воспламеняется, реакция протекает весьма энергично с образованием различных кислородных кислот фосфора (в основном ортофосфорной кислоты):
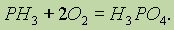
Так же легко, как с кислородом, протекает взаимодействие фосфора с хлором, и в зависимости от условий образуется либо РСl3, либо PCl5.
Оксиды фосфора. Фосфор образует несколько оксидов. Важнейшими из них являются Р4O6 и Р4О10. Часто их формулы пишут в упрощенном виде как Р2О3 и P2O5 (индексы предыдущих разделены на 2).
Оксид фосфора (III) Р4O6 — воскообразная кристаллическая масса, плавящаяся при 22,5° С. Получается сжиганием фосфора при недостатке кислорода. Сильный восстановитель. Очень ядовит.
Оксид фосфора (V) Р4О10 — белый гигроскопичный порошок. Получается при горении фосфора в избытке воздуха или кислорода. Он очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Оксиды и все кислородные соединения фосфора намного прочнее аналогичных соединений азота, что следует объяснить ослаблением неметаллических свойств у фосфора по сравнению с азотом.
Оксид фосфора (V).P2O5 энергично взаимодействует с водой, а также отнимает воду от других соединений. Именно поэтому P2O5 широко используется как осушитель различных веществ от паров воды.
Фосфорный ангидрид, взаимодействуя с водой, образует в первую очередь метафосфорную кислоту НРО3:
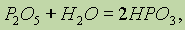
при кипячении раствора метафосфорной кислоты образуется ортофосфорнаякислота H3PO4:
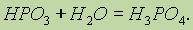
При нагревании H3PO4 можно получить пирофосфорную кислоту H4P2O7:
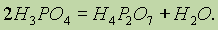

Ортофосфорная кислота.Наибольшее практическое значение имеет ортофосфорная кислота Н3РO4 (часто эту кислоту называют просто фосфорной).
Фосфорная кислота представляет собой белое твердое вещество, хорошо растворимое в воде. В отличие от азотной кислоты не является окислителем и не разлагается при нагревании, что объясняется наибольшей устойчивостью степени окисления +5 из всех возможных для фосфора. В промышленности фосфорная кислота получается двумя способами: экстракционным и термическим.
В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
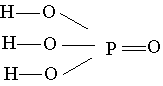
В водном растворе фосфорная кислота диссоциирует ступенчато. Как трехосновная кислота, НзР04 образует три типа солей: дигидрофосфаты(замещен один атом водорода кислоты), например NaH2PO4; гидрофосфаты(замещены два атома водорода кислоты), например Na2HPO4; фосфаты(замещены все атомы водорода в фосфорной кислоте), например Na3PO4.
Все дигидрофосфаты растворимы в воде. Из гидрофосфатов и фосфатов в воде растворимы только соли щелочных металлов и аммония.
Соли фосфорной кислоты. Соли фосфорной кислоты являются ценными минеральными удобрениями. Наиболее распространенные фосфорные удобрения — суперфосфат, преципитат и фосфоритная мука. Простой суперфосфат — смесь дигидрофосфата кальция Са(H2PO4)2, гидрофосфата кальция СаH2PO4, фосфата кальция Са3(РO4)2, а также апатита, гипса и других примесей. Его получают, обрабатывая фосфориты и апатиты серной кислотой. При обработке минеральных фосфатов фосфорной кислотой получают двойной суперфосфап Са(H2PO4)2. При гашении фосфорной кислоты известью получают преципитат СаНPO4× 2Н2O.
Более важное значение имеют сложные удобрения (т. е. содержащие одновременно азот и фосфор или азот, фосфор и калий — основные компоненты удобрений). Из них наиболее известен аммофос — смесь NH4H2PO4 и (NH4)2HPO4.
Кремний
Свойства 14Si.
Нахождение в природе.Кремний после кислорода — самый распространенный элемент в земной коре. В отличие от углерода в свободном состоянии кремний в… Природные силикаты имеют сложный состав и строение. Вот состав некоторых… Силикаты, содержащие в своем составе также оксид алюминия, называются алюмосиликатами. Из названных выше силикатов…– Конец работы –
Используемые теги: основные, понятия, химии0.063
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Основные понятия химии
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов