Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН. Водородный показатель численно равен отрицательному десятичному логарифму активности или концентрации ионов водорода, выраженной в молях на литр: pH=-lg[ H+ ] В воде концентрация ионов водорода определяется электролитической диссоциацией воды по уравнению H2O=H++OH- Константа диссоциации при 22° С составляет 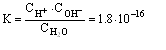 Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной обшей концентрации воды, которая составляет: С[H2O ]=1000/18=55,55моль/л. Тогда:
C[ H+ ] ·C[ OH- ]=K·C[H2O]=1,8·10-16·55,55=10-14 Для воды и ее растворов произведение концентраций ионов Н+ и ОН- величина постоянная при данной температуре. Она называется ионным произведением воды КВ и при 25° С составляет 10-14. Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов H+если известна концентрация ионов OH- и наоборот: Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной обшей концентрации воды, которая составляет: С[H2O ]=1000/18=55,55моль/л. Тогда:
C[ H+ ] ·C[ OH- ]=K·C[H2O]=1,8·10-16·55,55=10-14 Для воды и ее растворов произведение концентраций ионов Н+ и ОН- величина постоянная при данной температуре. Она называется ионным произведением воды КВ и при 25° С составляет 10-14. Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов H+если известна концентрация ионов OH- и наоборот: 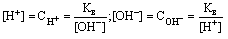 . Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл. В случае, если [ H+ ] =[ OH- ]эти концентрации (каждая из них) равны . Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл. В случае, если [ H+ ] =[ OH- ]эти концентрации (каждая из них) равны 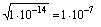 моль/л, т.е [ H+ ] =[ OH- ]=10-7моль/л и среда нейтральная, в этих растворах pH=-lg[ H+ ]=7 и рОН=-lg[ OH-]=7 Если [ H+ ]>10-7моль/л, [ OH-]<10-7моль/л -среда кислая; рН<7. Если [ H+ ]<10-7 моль/л, [ OH-]>10-7моль/л -среда щелочная; рН>7. В любом водном растворе рН + рОН =14, где рОН=-lg[ OH-] Величина рН имеет большое значение для биохимических процессов, для различных производственных процессов, при изучении свойств природных вод и возможности их применения и т.д. моль/л, т.е [ H+ ] =[ OH- ]=10-7моль/л и среда нейтральная, в этих растворах pH=-lg[ H+ ]=7 и рОН=-lg[ OH-]=7 Если [ H+ ]>10-7моль/л, [ OH-]<10-7моль/л -среда кислая; рН<7. Если [ H+ ]<10-7 моль/л, [ OH-]>10-7моль/л -среда щелочная; рН>7. В любом водном растворе рН + рОН =14, где рОН=-lg[ OH-] Величина рН имеет большое значение для биохимических процессов, для различных производственных процессов, при изучении свойств природных вод и возможности их применения и т.д.
|
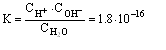 Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной обшей концентрации воды, которая составляет: С[H2O ]=1000/18=55,55моль/л. Тогда:
C[ H+ ] ·C[ OH- ]=K·C[H2O]=1,8·10-16·55,55=10-14 Для воды и ее растворов произведение концентраций ионов Н+ и ОН- величина постоянная при данной температуре. Она называется ионным произведением воды КВ и при 25° С составляет 10-14. Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов H+если известна концентрация ионов OH- и наоборот:
Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной обшей концентрации воды, которая составляет: С[H2O ]=1000/18=55,55моль/л. Тогда:
C[ H+ ] ·C[ OH- ]=K·C[H2O]=1,8·10-16·55,55=10-14 Для воды и ее растворов произведение концентраций ионов Н+ и ОН- величина постоянная при данной температуре. Она называется ионным произведением воды КВ и при 25° С составляет 10-14. Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов H+если известна концентрация ионов OH- и наоборот: 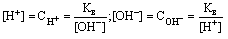 . Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл. В случае, если [ H+ ] =[ OH- ]эти концентрации (каждая из них) равны
. Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл. В случае, если [ H+ ] =[ OH- ]эти концентрации (каждая из них) равны 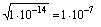 моль/л, т.е [ H+ ] =[ OH- ]=10-7моль/л и среда нейтральная, в этих растворах pH=-lg[ H+ ]=7 и рОН=-lg[ OH-]=7 Если [ H+ ]>10-7моль/л, [ OH-]<10-7моль/л -среда кислая; рН<7. Если [ H+ ]<10-7 моль/л, [ OH-]>10-7моль/л -среда щелочная; рН>7. В любом водном растворе рН + рОН =14, где рОН=-lg[ OH-] Величина рН имеет большое значение для биохимических процессов, для различных производственных процессов, при изучении свойств природных вод и возможности их применения и т.д.
моль/л, т.е [ H+ ] =[ OH- ]=10-7моль/л и среда нейтральная, в этих растворах pH=-lg[ H+ ]=7 и рОН=-lg[ OH-]=7 Если [ H+ ]>10-7моль/л, [ OH-]<10-7моль/л -среда кислая; рН<7. Если [ H+ ]<10-7 моль/л, [ OH-]>10-7моль/л -среда щелочная; рН>7. В любом водном растворе рН + рОН =14, где рОН=-lg[ OH-] Величина рН имеет большое значение для биохимических процессов, для различных производственных процессов, при изучении свойств природных вод и возможности их применения и т.д.
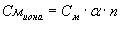 где См иона – молярная концентрация иона в моль/л; См – молярная концентрация электролита в моль/л; α-степень диссоциации электролита; n -количество ионов данного вида, которое получается при распаде одной молекулы электролита. Если электролит слабый, то значение степени диссоциации может быть определено на основании закона разбавления Оствальда:
где См иона – молярная концентрация иона в моль/л; См – молярная концентрация электролита в моль/л; α-степень диссоциации электролита; n -количество ионов данного вида, которое получается при распаде одной молекулы электролита. Если электролит слабый, то значение степени диссоциации может быть определено на основании закона разбавления Оствальда:
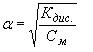 тогда CMиона=См·α·n =v СMКдис
тогда CMиона=См·α·n =v СMКдис