рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Атомно молекулярные учения в химии. Атом. Молекула. Химический элемент. Моль. Простые сложные вещества. Примеры
Реферат Курсовая Конспект
Атомно молекулярные учения в химии. Атом. Молекула. Химический элемент. Моль. Простые сложные вещества. Примеры
Атомно молекулярные учения в химии. Атом. Молекула. Химический элемент. Моль. Простые сложные вещества. Примеры - раздел Химия, Билет 1 ...
Билет 1
Атомно молекулярные учения в химии. Атом. Молекула. Химический элемент. Моль. Простые сложные вещества. Примеры.
Теоретическую основу современной химии составляет атомно-молекулярное учение.
Атомы – мельчайшие химические частицы, являющиеся пределом химического
разложения любого вещества.
Химический элемент представляет собой вид атомов с одинаковым положительным
зарядом ядра.
Следовательно, атом – это наименьшая частица химического элемента,
сохраняющая все его химические свойства. В настоящее время известно 110
элементов, из которых 92 встречаются в природе.
В зависимости от природы частиц, из которых построено вещество, различают
вещества с молекулярной и немолекулярной структурой. Практически все
органические вещества (т.е. подавляющее большинство известных веществ)
состоят из молекул. Среди неорганических соединений молекулярное строение
имеют примерно 5%. Таким образом, наиболее типичной формой существования
вещества является молекула.
Молекула – наименьшая частица вещества, способная существовать самостоятельно
и сохраняющая его основные химические свойства.
При обычных условиях вещества с молекулярной структурой могут находиться в
твердом, жидком или газообразном состоянии. Вещества с немолекулярной
структурой находятся только в твердом состоянии, преимущественно в
кристаллической форме. Носителями химических свойств таких веществ являются
не молекулы, а комбинации атомов или ионов которые образуют данное вещество.
Символическая запись простейшего численного соотношения, в котором атомы
различных элементов образуют химическое соединение, называется формулой.
Следовательно, формула выражает определенный (качественный и количественный)
состав соединения. Так, SO2, N2, CO - формулы веществ, имеющих молекулярное
строение. Их состав всегда строго постоянен. NaCl, AlF3, ZnS– формулы веществ,
не имеющих молекулярное строение при обычных условиях. Состав таких веществ не
всегда постоянен и часто зависит от условия их получения. Отклонение от
целочисленного соотношения могут быть выражены при записи формулы: Fe0,9S,
TiO0,7, ZrN0,69. Вещества с постоянным составом называются дальтонидами,
вещества с переменным составом – бертоллидами.
Массы атомов химических элементов чрезвычайно малы. В химии пользуются не их
абсолютными значениями, а относительными.
Относительной атомной массой химического Ar элемента называется величина,
равная отношению средней массы атомов данного элемента (с учетом процентного
содержания его изотопов в природе ) к 112 массы изотопов углерода – 12.
112 массы атома изотопа углерода 12 принята за атомную единицу массы
(а. е. м.), международное обозначение - u.
Относительная атомная масса является величиной безразмерной.
Относительной молекулярной массой Mr вещества называется отношение массы его
молекулы к 112 массы атома изотопа углерода 12.
Поскольку большинство неорганических веществ при обычных условиях не имеют
молекулярного строения, в данном случае можно говорить о формульной массе
F, понимая под ней сумму атомных масс всех элементов, входящих в
соединение, с учетом числа атомов каждого элемента в формуле.
Единицей измерения количества вещества n (ν) в Международной системе единиц
является моль.
Моль – количество вещества, содержащее столько структурных элементарных
единиц (атомов, ионов, молекул, электронов, эквивалентов и т.д.), сколько
содержится атомов в 0,012 кг изотопа углерода 12.
Число атомов NA в 0,012 кг углерода (т.е. в 1моль) легко определить, зная массу
атома углерода. Точное значение этой величины – 6,02·10²³ . Эта
величина называется постоянной Авогадро и является одной из важнейших
универсальных постоянных. Она равна числу структурных единиц в 1 моль любого
вещества.
Масса 1 моль вещества Х называется молярной массой М(Х) и представляет
собой отношение массы m этого вещества к его количеству n.
Закон сохранения массы: «Масса веществ, вступивших в химическую реакцию,
равна массе веществ, образовавшихся в результате реакции, с учетом массы,
соответствующей тепловому эффекту реакции». Он был сформулирован великим
русским ученым М.В.Ломоносовым в 1748г. и подтвержден экспериментально им самим
в 1756г. и независимо от него французским химиком А.Л.Лавуазье в 1789г.
Закон постоянства состава вещества: «Любое сложное вещество молекулярного
строения независимо от способа получения имеет постоянный количественный
состав».
Закон Авогадро: «В равных объемах различных газов при одинаковых условиях
содержится одно и то же количество молекул».
Следствия: 1. Если число молекул некоторых газов равно, то при н.у.
они занимают равные объемы. Если же число молекул равно
6,02·10²³, то объем газа равен 22,4 л. Этот объем называется
молярным объемом.
1. Абсолютная плотность газа равна отношению его молекулярной массы к
молярному объему
2. Относительная плотность газа (Х) по другому газу (Y) равна отношению
молярной массы газа (Х) к молярной массе газа (Y).
Уравнение Клаперона:
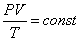
| 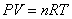
| 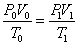
| |||
Уравнение Менделеева-Клаперона:
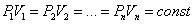
|
Уравнение Бойля-Мариотта:
Уравнение Шарля-Гей-Люсака:
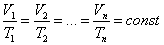
|
Билет 2
Оксиды: основные, кислотные, амфотерные. Способы получения и свойства. Номенклатура. Примеры.
Оксидами называются сложные вещества, в состав молекул которых входят атомы
кислорода и какого-нибудь другого элемента.
Оксиды могут быть получены как при непосредственном взаимодействии кислорода
с другим элементом, так и косвенным путем (например, при разложении солей,
кислот, оснований). В обычных условиях оксиды бывают в твердом, жидком и
газообразном состоянии.
В зависимости от того, будет этим другим элементом металл или неметалл,
оксиды делятся на основные и кислотные.
Основными оксидами называются такие оксиды металлов, которым соответствуют
гидраты, относящиеся к классу оснований.
Если в качестве второго элемента будет неметалл или металл, проявляющий высшую
валентность, то такие оксиды будут кислотными. Кислотными оксидами
(ангидридами кислот) называются такие оксиды, которым соответствуют гидраты,
относящиеся к классу кислот.
Особую группу составляют амфотерные окисиды. Амфотерными оксидами называются
оксиды, которые взаимодействуют как с кислотами, так и с основаниями, образуя
соли.
H2O + ZnCl2 ← 2HCl + ZnO + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие.
Солеобразующие оксиды – оксиды, которые в результате реакций образуют соли.
CuO + 2HCl → CuCl2 + H2O;
CuO + SO3 → CuSO4
Несолеобразующие оксиды солей не образуют!
Элементы, обладающие постоянной СО, образуют оксиды одной из перечисленных
групп. Элементы, проявляющие переменную СО могут образовывать различные
оксиды. Как правило, в низшей степени окисления элемент образует основный
оксид, в переходной СО – амфотерный, в высшей – кислотный.
| Основные 1. Na2O + H2O → 2NaOH 2. Na2O + SO3 → Na2SO4 3. CuO + H2SO4 → CuSO4 + H2O | Кислотные 1. SO3 + H2O → H2SO4 2. CO2 + CaO → CaCO3 3. CO2 + Ba(OH)2 → BaCO2 + H2O |
Номенклатура оксидов
Если элемент, образующий оксид, имеет единственную степень окисления, то ее в названии оксида можно не указывать: Na2O – оксид натрия. Если же элемент образует несколько оксидов, то это необходимо: MnO – оксид марганца (II), MnO2 – оксид марганца (IV), Mn2O7 – оксид марганца (VII). По реже используемой в неорганической химии систематической номенклатуре, требующей полного отражения состава соединений, оксиды называются так: CrO – хром оксид, Cr2O3 – дихром триоксид.
Амфотерные оксиды образуют соли:
1) при взаимодействии с сильными кислотами (как основные оксиды):
Al2O3+6HNO3®2Al(NO3)3+3H2O;
2) при реакции со щелочами (как кислотные оксиды):
Al2O3+2NaOH®2NaAlO2+H2O (в расплаве),
Al2O3+6NaOH+3H2O®2Na3[Al(OH)6] (в растворе);
3) при нагревании с кислотными или основными оксидами:
ZnO+SO3®ZnSO4,
ZnO+Na2O®Na2ZnO2;
амфотерные гидроксиды в воде не растворяются
Получение оксидов
1) окисление простых веществ:
S+O2®SO2,
2Сu+O2®2CuO;
2) разложение сложных веществ:
а) дегидратация кислородсодержащих кислот:
H2CO3«CO2↑+H2O,
H2SiO3®SiO2+H2O;
б) дегидратация нерастворимых оснований при нагревании:
Сu(OH)2®CuO+H2O;
в) термическое разложение некоторых солей:
CaCO3®CaO+CO2↑,
2Cu(NO3)2®2CuO+4NO2↑+O2↑;
3) горение органических соединений:
CH4+2O2®CO2+2H2O;
4) горение летучих водородных соединений (кроме галогеноводородов):
2H2S+3O2®2SO2+2H2O,
4NH3+5O2®4NO+6H2О;
5) обжиг сульфидов тяжелых металлов:
2CuS+3O2®2CuO+2SO2,
4FeS2+11O2®2Fe2O3+8SO2;
6) окисление и восстановление оксидов:
2CO+O2®2CO2,
6FeO+O2®2Fe3O4,
CO2+C ®2CO;
7) взаимодействие H2SO4(конц.) и HNO3 с металлами:
Cu+2H2SO4(конц.)®CuSO4+SO2↑+2H2O,
Pb+4HNO3(конц.)→Pb(NO3)2+2NO2↑+2H2O,
3Ag+4HNO3(разб.)®3AgNO3+NO↑+2H2O.
Билет 3
Основания. Способы получения. Свойства. Амфотерные гидроксиды. Номенклатура. Примеры. Привести примеры электролитической диссоциации.
Основаниями называются сложные вещества, молекулы которых состоят из атома
металла и одной или нескольких гидроксильных групп.
Число гидроксильных групп в молекуле основания зависит от степени скисления
металла и равно ее абсолютной величине.
Все основания – твердые вещества, имеющие различную окраску. Основания щелочных
и щелочноземельных металлов хорошо растворимы в воде и называются
щелочами. Остальные основания плохо растворяются в воде.
Химические свойства оснований обусловливаются отношением их к кислотам,
ангидридам кислот и солям.
1. CO2 + Ba(OH)2 → BaCO3 + H2O
2. 2KOH + H2SO4 → K2SO4 + 2H2O
Реакция взаимодействия основания с кислотой называется реакцией
нейтрализации, т.к. после ее окончания среда должна стать нейтральной.
3. 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4.
Химические свойства оснований
1. Химические свойства щелочей: 1) взаимодействие с кислотными оксидами: 2KOH+CO2®K2CO3+H2O;Получение оснований
1. Получение щелочей: 1) взаимодействие щелочных или щелочноземельных металлов или их оксидов с… Сa+2H2O®Ca(OH)2+H2,Билет 4
Кислоты способы получения. Свойства. Номенклатура. Составить формулы метахромистой кислоты, теллуроводородной кислоты, тетраборной кислоты, ортомышьяковой кислоты. Приведите примеры их электролитической диссоциации.
Кислотами называются сложные вещества, в состав молекул которых входят атомы
водорода, способные замещаться или обмениваться на металл.
По числу атомов водорода, способных к отщеплению в водном растворе, кислоты
делят на одноосновные, двухосновные и трехосновные.
По составу кислоты делятся на бескислородные и кислородсодержащие.
Получение кислот:
1. Бескислородные кислоты могут быть получены при непосредственном
взаимодействии неметалла с водородом:
H2 + S → H2S
2. Кислородсодержащие кислоты нередко могут быть получены при
растворении кислотных оксидов в воде:
SO3 + H2O → H2SO4
3. Как бескислородные, так и кислородсодержащие кислоты можно получить
по реакции обмена между солями и другими кислотами:
BaBr2 + H2SO4 → BaSO4 + 2HBr
CuSO4 + H2S → H2SO4 + CuS
4. В некоторых случаях для получения кислот могут быть использованы ОВ
процессы:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO
Химические свойства кислот обусловлены отношением их к основаниям, металлам,
солям и основным оксидам.
1. CuO + H2SO4 → CuSO4 + H2O
2. 2KOH + H2SO4 → K2SO4 + 2H2O
3. Zn + 2HCl → ZnCl2 + H2
4. CuCl2 + H2SO4 → CuSO4 + 2HCl
Номенклатура кислот
В случае кислородсодержащих кислот окончание –водородная отсутствует: HNO3 – азотная, H2CrO4 – хромовая. Названия кислот, в которых степень… В названиях кислот элементов IV – VI групп низшие степени окисления… Названия кислот следует образовывать с приставками мета-, ди-, орто-, если это способствует уточнению формулы кислоты,…Химические свойства кислот
Действие растворов кислот на индикаторы: фенолфталеин – бесцветный, метилоранж окрашивается в красный цвет, лакмус – в красный. 1) Взаимодействие с металлами. Характер продуктов зависит от природы и концентрации кислот и активности металлов. Разбавленные кислоты (кроме HNO3)…Получение кислот
SO3+H2O®H2SO4, P2O5+3H2O®2H3PO4; 2) вытеснение слабых, летучих или малорастворимых кислот из солей:Билет 5
Кислые соли. Способы получения и свойства. Номенклатура. Составить формулы солей: гидросульфида натрия, дигидробората калия, гидрофосфата натрия. Приведите примеры уравнений их электролитической диссоциации.
Кислыми (гидросолями) называются соли, образующиеся в результате неполного замещения ионов водорода кислоты ионами металла.
Одноосновные кислоты не образуют кислых солей, поскольку их молекулы содержат только один ион Н+.
Двухосновные кислоты, такие, как H2SO4, H2SO3, H2CO3 и другие, образуют кислые соли, содержащие отрицательно заряженные ионы HSO4-, HSO3-, HCO3-, называемые, соответственно, гидросульфат-, гидросульфит- и гидрокарбонат-ионами.
Заряды этих ионов определяются как результат отрыва одного положительно заряженного иона Н+ от нейтральной молекулы кислоты по схеме:
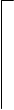 | 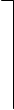 |  | |||
| O | О-Н | O | O | — | ||||||||
| S | « | S | + | H+ | ||||||||
| // | // | |||||||||||
| O | О-Н | O | O-Н |
 |  |
Зная заряд иона, входящего в состав кислой соли, и иона металла, нетрудно написать формулу кислой соли. Применительно к серной кислоте, кислые соли которой содержат ион HSO4-, формулы будут иметь следующий вид:
для однозарядных катионов металлов – NaHSO4, KHSO4;
для двухзарядных катионоа металлов – Mg(HSO4)2, Zn(HSO4)2;
для трехзарядных катионов металлов– Al(HSO4)3, Fe(HSO4)3.
Трехосновные кислоты, такие как H3PO4, H3AsO4 и некоторые другие, способны образовать два типа кислых солей.
При замещении одного иона Н+ ионом металла, два других иона входят в состав однозарядного отрицательного иона H2PO4- (дигидроортофосфат-иона), образующего кислую соль:
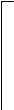 | 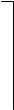 |  | |||
| О-Н | O— | ||||||||||||||
| O | ═ | P | — | О-Н | « | O | ═ | P | — | О-Н | + | H+ | |||
| О-Н | О-Н |


Поскольку соли, содержащие ион H2PO4- или H2AsO4- получены в результате замещения одного иона Н+ в молекуле кислоты ионом металла, они получили названия однозамещенных кислых солей или первичных кислых солей. Однозамещенные кислые соли для металлов с различной степенью окисления имеют следующие формулы:
NaH2PO4, Ca(H2PO4)2, Al(H2PO4)3.
Графические формулы которых представлены ниже:
| H-O | H-O | ||||||||||||||||||||||
| H-O | — | P═O | H-O | — | P═O | ||||||||||||||||||
| Na-O | O | O-H | O | ||||||||||||||||||||
| H-O | — | P═Oyyyyjjj | Ca | yyy | O═P | — | O | — | Al | ||||||||||||||
| H-O | O | O-H | O | ||||||||||||||||||||
| H-O | — | P═O | H-O | — | P═O | ||||||||||||||||||
| H-O | H-O | ||||||||||||||||||||||
В соответствии с русской номенклатурой эти соли следует называть: однозамещенные кислые фосфорнокислые натрий, кальций и алюминий соответственно.
В соответствии с международной номенклатурой кислые соли называют: дигидрофосфат натрия, кальция и алюминия.
В другом случае происходит замещение двух ионов Н+ ионами металла, а третий ион Н+ входит в состав двухзарядного отрицательного иона HPO42- (гидрофосфат-иона), образующего кислую соль:
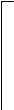 | 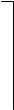 |
| О-Н | О— | 2- | ||||||||||||||
| O | ═ | P | — | О-Н | « | O | ═ | P | — | О— | + | 2H+ | ||||
| О-Н | О-Н |


Кислые соли, полученные в результате замещения двух ионов Н+ ионами металла, называются двухзамещенными кислыми солями или вторичными кислыми солями, например,
Na2HPO4, CaHPO4, Al2(HPO4)3.
Графические формулы этих солей имеют вид:
| H-O | ||||||||||||||||||||||
| O | — | P═O | ||||||||||||||||||||
| Al | — | O | ||||||||||||||||||||
| Na-O | O | O | ||||||||||||||||||||
| Ca | ||||||||||||||||||||||
| Na-O | — | P═O | O | — | P═O | H-O | — | P═O | ||||||||||||||
| H-O | H-O | O | ||||||||||||||||||||
| Al | — | O | ||||||||||||||||||||
| O | — | P═O | ||||||||||||||||||||
| H-O |
Для четырехосновной кислоты, например, H4P2O7, теоретически возможны три типа кислых солей, а именно:
1) однозамещенные или тригидродифосфаты, содержащие однозарядный ион H3P2O7-,
NaH3P2O7, Ca(H3P2O7)2, Al(H3P2O7)3;
2) двухзамещенные или дигидродифосфаты, содержащие двухзарядный ион H2P2O72-,
Na2H2P2O7, CaH2P2O7, Al2(H2P2O7)3;
3) трехзамещенные или гидродифосфаты, содержащие трехзарядный ион HP2O73-,
Na3HP2O7, Ca3(HP2O7)2, AlHP2O7.
Химические свойства кислых солей
KH2PO4+2KOH®K3PO4+2H2O, KH2PO4+KOH®K2HPO4+H2O, K2HPO4+KOH®K3PO4+H2O,Получение кислых солей
1) реакцией неполной нейтрализации многоосновной кислоты основанием: 2H2SO4+Cu(OH)2®Cu(HSO4)2+2H2O; 2) взаимодействием многоосновной кислоты и ее средней соли:Билет 6
Основные соли.
Однокислотные основания, например, NaOH, KOH, NH4OH и другие, не образуют основных солей, поскольку их молекулы содержат только один ион ОН-,… Двухкислотные основания, такие как Mg(OH)2, Cu(OH)2, Mn(OH)2 и другие,… Заряды этих ионов определяются как результат отрыва отрицательно заряженного иона ОН- от нейтральной молекулы…Химические свойства основных солей
Fe(OH)2Cl+2HCl®FeCl3+2H2O, Fe(OH)2Cl+HCl®Fe(OH)Cl2+H2O, Fe(OH)Cl2+HCl®FeCl3+H2O,Получение основных солей
1) реакцией неполной нейтрализации основания кислотой: 2Cu(OH)2+H2SO4®(CuOH)2SO4+2H2O; 2) взаимодействием средней соли и щелочи (недостаток):Билет 7
Средние соли.
Чтобы правильно написать формулу какой-либо соли, следует учитывать величины зарядов, положительного – иона металла и отрицательного – кислотного… При изображении графической формулы соли не следует терять из вида структуру… — О O …Номенклатура средних солей
К названиям солей, содержащих металл с переменной степенью окисления, добавляют слова закисный (низшая степень окисления металла) и окисный (высшая… Название соли бескислородной кислоты состоит из названия неметалла, взятого в… Можно также в названии соли указывать число атомов галогена, приходящихся на один атом металла: SnCl2 – двухлористое…Химические свойства средних солей
2) взаимодействие солей с металлами идет только в том случае, если более активный металл вытесняет менее активный металл из его солей (см.… CuSO4+Fe®FeSO4+Cu; 3) соли малорастворимых оснований взаимодействуют со щелочами с образованием или основания, или основной соли (при…Получение средних солей
Таблица 2. Способы получения средних солей Неметаллы …Билет 8
Строение атома.
Атом любого элемента состоит из ядра и и электронной оболочки. Ядро состоит из протонов и нейтронов. Количество протонов равно порядковому номеру элемента. Число нейтронов в… равно разности между массовым числом изотопа и порядковым номером.Билет 9
Билет 10
Состав атомных ядер
Количество протонов равно порядковому номеру элемента. Число нейтронов в ядре равно разности между массовым числом изотопа и порядковым номером. Массовое число – сумма количества нейтронов и протонов в ядре. ОноБилет 11
Электрон
Предложенная модель строения атома позволила Н. Бору описать поведение электрона в атоме водорода и предсказать полный спектр его излучения… 1. Постулаты Н. Бора противоречили законам механики, но сами законы… 2. Не объяснялся способ перехода электрона с одной орбиты на другую и его промежуточное состояние в процессе…Билет 12
Правило заполнения электронных уровней, подуровней элементов
Билет 13
Энергия ионизации, сродства к электрону, электроотрицательность.
Э + I = Э+ + е- Энергия ионизации выражается в кДж/моль или эВ/моль. Энергии, необходимые для… Энергия ионизации возрастает в периодах от щелочных металлов к благородным газам и уменьшается в группах сверху вниз.…Билет 14
Ковалентная связь
Первая теория ковалентной связи принадлежит американскому физикохимику Г.-Н. Льюису. В 1916 г. он предположил, что связи между двумя атомами… Одно из существенных свойств ковалентной связи - ее насыщаемость. При… Для описания ковалентной связи используют преимущественно два метода, основанных на разных приближениях при решении…Билет 15
Сигма и пи связи.
В молекуле этилена С2Н4 имеется двойная связь СН2=СН2, его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости.… В линейной молекуле ацетилена Н—С≡С—Н (Н : С ::: С : Н)Билет 16
Образование ковалентной связи по донорно-акцепторному механизму.
H+ + H- → H2 При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона… Распределение электронной плотности между ядрами в молекуле водорода одно и то же, независимо от механизма…Билет 17
Химическая связь и геометрия молекул. BI3, PI3
Химическая связь обычно изображается черточками, соединяющими взаимодействующие атомы; каждая черта эквивалентна обобщенной паре электронов. В… Полярность молекулы определяется разностью электроотрицательностей атомов,… *) Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от…Билет 18
Полярная и неполярная связь
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания…Билет 19
Ионная связь
Таким образом, процесс образования ионной связи сводится к переходу электронов от атомов натрия к атомам хлора с образованием противоположно… Экспериментально установлено, что в действительности электроны не отрываются… Соединения, в которых вклад ионной связи значителен, принято называть ионными. Большинство бинарных соединений,…Билет 20
Степень окисления
Степень окисления 1. Степень окисления — условный заряд атома в соединении, вычисленный исходя из предположения о том, что все электроны сместились… ВАЛЕНТНОСТЬ (от лат. valentia — сила), способность атома химического элемента (или атомной группы) образовывать…Билет 21
Водородная связь
Водородная связь образуется между электроотрицательными атомами, из которых хотя бы один имеет свободную электронную пару, например: (водородная связь обозначается пунктиром из трех точек).Билет 22
Кристаллические решётки
К каждой частице, находящейся в кристалле, примыкает вплотную только определенное число соседних частиц. Это число ближайших соседних частиц… Например, в металлическом кристалле натрия (повторяем здесь рис. 3-13 из…Билет 23
Растворы
Растворы не отстаиваются и сохраняются все время однородными. Если раствор профильтровать через самый плотный фильтр, то ни соль, ни сахар, ни… Растворами называются гомогенные (т.е. однородные) смеси переменного состава… Под переменным составом раствора понимают то простое обстоятельство, что соотношение смешанных друг с другом веществ…Билет 24,25
Электролитическая диссоциация
Слабые электролиты Слабые электролиты — химические соединения,молекулы которых даже в сильно… Слабыми электролитами являются:Билет 26
Механизм диссоциации.
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как Жидкий аммиак и жидкий диоксид серы. Однако… Сила электролитов. Силу электролитов можно охарактеризовать с помощью степени диссоциации. Степень диссоциации электролита-это частное от…Билет 27
Ионные уравнения.
Билет 28
Ионное произведение воды
Билет 29
Химическая реакция
В отличие от ядерных реакций, в химических реакциях не затрагиваются ядра атомов. Все изменения происходят только во внешних электронных оболочках.… Химическими реакциями называются явления, при которых одни вещества,… Записывать химическую реакцию с помощью рисунков молекул не слишком удобно. Поэтому для записи химических реакций…Билет 30
ОВР
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окисление — это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдает свои электроны, то он приобретает положительный заряд:

Если отрицательно заряженный ион (заряд -1), например Сl- , отдает 1 электрон, то он становится нейтральным атомом:
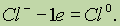
Если положительно заряженный ион или атом отдает электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
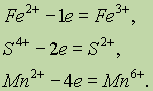
Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.
Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:

Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается:
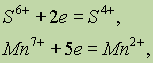
или он может перейти в нейтральный атом:
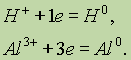
Окислителем является атом, молекула или ион, принимающий электроны.
Восстановителем является атом, молекула или ион, отдающий электроны.
Окислитель в процессе реакции восстанавливается, восстановитель — окисляется.
Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому.
Однако для составления уравнений окислительно-восстановительных реакций не имеет существенного значения, какая связь при этом образуется — ионная или ковалентная. Поэтому для простоты будем говорить о присоединении или отдаче электронов независимо от типа связи.
Билет 31
Методы расстановки коэффициентов в ОВР
• Метод полуреакций (электронно-ионного баланса) 1). Записываем уравнение химической реакции и определяемся, какое вещество окислитель, какое… 5). Расставляем коэфициенты в молекулярном уравнении: 3H2S + K2Cr2O7 + 4H2SO4…Билет 32
Гидролиз
Гидролиз – процесс обменного взаимодействия ионов соли с водой, приводящий к образованию малодиссоциированных веществ и сопровождающийся изменением… Суть гидролиза солей заключается в том, что происходит смещение равновесия… а) Соль образована слабой кислотой и сильным основанием (K2S).Билет 33
Билет 34
Скорость химических реакций
V = ± ((С2 – С1) / (t2 - t1)) = ± (DС / Dt)Факторы, влияющие на скорость химических реакций
Примеры
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди - не реагирует.
2. Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает.
Закон действующих масс (К. Гульдберг, П.Вааге, 1867г.)
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
aA + bB + . . . ® . . .
V = k • [A]a • [B]b • . . .
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
3. Температура. При повышении температуры на каждые 10°C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле:
| (t2 - t1) / 10 | ||
| Vt2 / Vt1 | = g |
(где Vt2 и Vt1 - скорости реакции при температурах t2 и t1 соответственно; g- температурный коэффициент данной реакции).
Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса:
k = A • e –Ea/RT
где
A - постоянная, зависящая от природы реагирующих веществ;
R - универсальная газовая постоянная [8,314 Дж/(моль • К) = 0,082 л • атм/(моль • К)];
Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению.
Энергетическая диаграмма химической реакции.
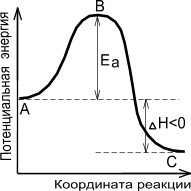
| 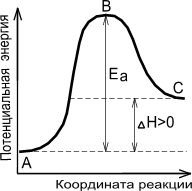
|
| Экзотермическая реакция | Эндотермическая реакция |
А - реагенты, В - активированный комплекс (переходное состояние), С - продукты.
Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
4. Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
5. Катализ. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа").
Билет 35
Энергия активации
А2 + В2 = 2АВ. В ходе химической реакции происходит перегруппировка атомов, сопровождающаяся…Билет 36
Катализ катализатор
Многие реакции в отсутствие катализаторов протекают очень медленно или не протекают совсем. Одной из таких реакций является разложение пероксида… 2Н2О2 = 2Н2О + О2. Если опустить в сосуд с водным раствором пероксида водорода кусочек твердого диоксида марганца, то начнется бурное…Билет 37
Химическое равновесие
У этой равновесной системы есть замечательное свойство: ее состав не зависит… Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и…Билет 38,41
Принцип Ле Шателье
Билет 39
Билет 40
Факторы влияющие на скорость химической реакции
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении… При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два…Билет 42
Закон Гесса
Анализ закона Гесса позволяет сформулировать следующие следствия: Энтальпия реакции равна разности сумм энтальпий образования конечных и… В ходе химической реакции энергия затрачивается на разрушение связей в… Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными…Билет 43
Тепловой эффект
Тепловой эффект обозначается символами Q или ΔH (Q = –ΔH). Его величина соответствует разности между энергиями исходного и конечного… ΔH = Hкон. – Hисх. = Eкон. – Eисх. Реакции, протекающие с выделением…– Конец работы –
Используемые теги: Атомно, Молекулярные, учения, химии, атом, молекула, Химический, элемент, Моль, простые, Сложные, вещества, меры0.152
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Атомно молекулярные учения в химии. Атом. Молекула. Химический элемент. Моль. Простые сложные вещества. Примеры
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов