Закон Гесса - раздел Химия, Атомно молекулярные учения в химии. Атом. Молекула. Химический элемент. Моль. Простые сложные вещества. Примеры Пользуясь Табличными Значениями ...
Пользуясь табличными значениями 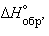
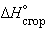 и
и 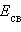 , можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
, можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
Анализ закона Гесса позволяет сформулировать следующие следствия:
- Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.
| ΔH = ΣΔHобр.конечн – ΣΔHобр.нач
|
- Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
| ΔH = ΣΔHсгор.нач – ΣΔHсгор.конечн
|
- Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов.
В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образованиии продуктов реакции (–ΣEпрод). Отсюда
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей.
- Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
- Энтальпия гидратации равна разности энтальпий растворения безводной соли
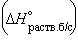 и кристаллогидрата
и кристаллогидрата 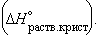
Из вышесказанного видно, что закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Термохимические уравнения.На первых этапах изучения химии вы часто пользовались равным по абсолютной величине и противоположным по знаку обозначением, например:
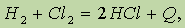
где Q — количество выделенной теплоты. Если использовать энтальпию (характеристику энергосодержания системы), то это уравнение следует записать иначе:
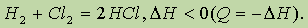

В справочных таблицах обычно приводят не значения величины Q, а значения величины D H, измеренные при определенных условиях (чаще всего при 298 К);их обозначают D H0.
Все темы данного раздела:
Химические свойства оснований
Общие свойства оснований обусловлены наличием в их растворах иона ОН-, создающего в растворе щелочную среду (фенолфталеин окрашивается в малиновый цвет, метилоранж – в желтый, лакмус – в
Получение оснований
1. Получение щелочей:
1) взаимодействие щелочных или щелочноземельных металлов или их оксидов с водой:
Сa+2H2O®Ca(OH)2+H
Номенклатура кислот
Названия кислот производятся от того элемента, от которого образована кислота. При этом в названии бескислородных кислот обычно имеется окончание –водородная: HCl – хлороводородная, HBr – бромоводо
Химические свойства кислот
Общие свойства кислот в водных растворах обусловлены присутствием ионов Н+, образующихся при диссоциации молекул кислоты, таким образом, кислоты – это доноры протонов: HxAn«xH+
Получение кислот
1) взаимодействие кислотных оксидов с водой:
SO3+H2O®H2SO4,
P2O5+3H2O®2H3PO4;
Химические свойства кислых солей
1) кислые соли содержат атомы водорода, способные принимать участие в реакции нейтрализации, поэтому они могут реагировать со щелочами, превращаясь в средние или другие кислые соли – с меньшим числ
Получение кислых солей
Кислую соль можно получить:
1) реакцией неполной нейтрализации многоосновной кислоты основанием:
2H2SO4+Cu(OH)2®Cu(HSO4)2+2H
Основные соли.
Основными (гидроксосолями) называются соли, которые образуются в результате неполного замещения гидроксидных ионов основания анионами кислот.
Однокислотные основания, например, NaOH, KOH,
Химические свойства основных солей
1) основные соли содержат гидроксогруппы, которые могут принимать участие в реакции нейтрализации, поэтому они могут реагировать с кислотами, превращаясь в средние соли или в основные соли с меньши
Получение основных солей
Основную соль можно получить:
1) реакцией неполной нейтрализации основания кислотой:
2Cu(OH)2+H2SO4®(CuOH)2SO4+2H2
Средние соли.
Средними солями называюся продукты полного замещения Н+-ионов кислоты ионами металлов; они также могут рассматриваться как продукты полного замещения ОН—ионов основания аниона
Номенклатура средних солей
В русской номенклатуре (используемой в технологической практике) существует следующий порядок наименования средних солей: к корню названия кислородсодержащей кислоты прибавляют слово
Химические свойства средних солей
1) Почти все соли являются ионными соединениями, поэтому в расплаве и в водном растворе они диссоциируют на ионы (при пропускании тока через растворы или расплавы солей идет процесс электролиза).
Получение средних солей
Большая часть методов получения солей основана на взаимодействии веществ противоположной природы – металлов с неметаллами, кислотных оксидов с основными, оснований с кислотами (см. таблицу 2).
Строение атома.
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Порядковый номер элемента в Периодической таблице элементов равен заряду ядра
Состав атомных ядер
Ядро состоит из протонов и нейтронов.
Количество протонов равно порядковому номеру элемента. Число нейтронов в ядре
равно разности между массовым числом изотопа и по
Электрон
Вокруг ядра вращаются электроны по определенным стационарныморбитам. Двигаясь по своей орбите, электрон не излучает и не поглощает электромагнитную энергию. Излучение или поглощение энергии происхо
Правило заполнения электронных уровней, подуровней элементов
Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение первых четырех энергетических уровней: для первог
Энергия ионизации, сродства к электрону, электроотрицательность.
Энергия ионизации атома. Энергия, необходимая для отрыва электрона от невозбужденного атома, называется первой энергией (потенциалом) ионизации I:
Э + I = Э+ + е-
Энергия ионизаци
Ковалентная связь
В большинстве случаев при образовании связи происходит обобществление электронов связываемых атомов. Такой тип химической связи называют ковалентной связью (приставка "ко-" в латинском яз
Сигма и пи связи.
Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна
Образование ковалентной связи по донорно-акцепторному механизму.
Кроме изложенного в предыдущем разделе гомогенного механизма образования ковалентной связи, существует гетерогенный механизм — взаимодействие разноименно заряженных ионов — протона H+ и
Химическая связь и геометрия молекул. BI3, PI3
рисунок 3.1Сложение дипольных элементов в молекулах NH3 и NF3
Полярная и неполярная связь
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании
Ионная связь
Ионная связь– это химическая связь, которая осуществляется за счет электростатического взаимодействия противоположно заряженных ионов.
Таким образом, процесс образования и
Степень окисления
Валентность 1. Валентность — способность атомов химических элементов образовывать определенное число химических связей. 2. Значения валентности изменяются от I до VII (редко VIII). Валент
Водородная связь
Помимо различных гетерополярных и го-меополярных связей, существует еще один особый вид связи, который в последние два десятилетия привлекает все большее внимание химиков. Это так называемая водоро
Кристаллические решётки
Итак, кристаллическая структура характеризуется правильным (регулярным) расположением частиц в строго определенных местах в кристалле. При мысленном соединении этих точек линиями получаются простра
Растворы
Если в сосуд с водой поместить кристаллы поваренной соли, сахара или перманганата калия (марганцовки), то мы можем наблюдать, как количество твердого вещества постепенно уменьшается. При этом вода,
Электролитическая диссоциация
Растворы всех веществ можно разделить на две группы: электролиты-проводят электрический ток, неэлектролиты-проводниками не являются. Это деление является условным, потому что все
Механизм диссоциации.
Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным-к иону хлора; окружают ио
Ионное произведение воды
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН. Водородный показатель численно ра
Химическая реакция
Химическая реакция - это превращение одних веществ в другие. Впрочем, такое определение нуждается в одном существенном дополнении. В ядерном реакторе или в ускорителе тоже одни вещества превращаютс
Методы расстановки коэффициентов в ОВР
• Метод электронного баланса 1). Записываем уравнение химической реакции KI + KMnO4 → I2 + K2MnO4 2). Находим атомы, изме
Гидролиз
Гидролиз – процесс обменного взаимодействия ионов соли с водой, приводящий к образованию малодиссоциированных веществ и сопровождающийся изменением реакции (pH) среды.
Суть
Скорость химических реакций
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ:
V = ± ((С2 – С1) / (t2 - t
Факторы, влияющие на скорость химических реакций
1. Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с
Энергия активации
Столкновение химических частиц приводит к химическому взаимодействию лишь в том случае, если сталкивающиеся частицы обладают энергией, превышающей некоторую определенную величину. Рассмотрим взаимо
Катализ катализатор
Многие реакции можно ускорить или замедлить путем введения некоторых веществ. Добавляемые вещества не участвуют в реакции и не расходуются в ходе ее протекания, но оказывают существенное влияние на
Химическое равновесие
Химические реакции, которые протекают со сравнимыми скоростями в обоих направлениях, называются обратимыми. В таких реакциях образуются равновесные смеси реагентов и продуктов, состав которы
Принцип Ле Шателье
Принцип Ле Шателье говорит о том, что для смещения равновесия вправо нужно, во-первых, повышать давление. Действительно, при повышении давления система будет «сопротивляться» возрастанию кон
Факторы влияющие на скорость химической реакции
Факторы, влияющие на скорость химической реакции
Увеличивают скорость
Уменьшают скорость
Наличие химически активных реагентов
Тепловой эффект
В ходе реакции происходит разрыв связей в исходных веществах и образование новых связей в продуктах реакции. Поскольку образование связи идет с выделением, а ее разрыв - с поглощением энергии, то х
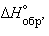
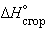 и
и 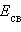 , можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
, можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».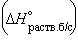 и кристаллогидрата
и кристаллогидрата 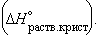
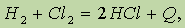
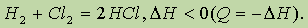








Новости и инфо для студентов