Способы получения
1. Взаимодействие с хлоридом фосфора (V):
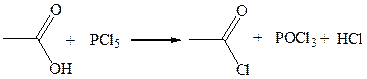
2. Взаимодействие с тионилхлоридом:
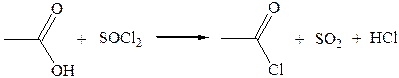
Характеристика реакционной способности. Галогенангидриды относятся к соединениям с высокой реакционной способностью. Они легко обменивают галоген на нуклеофильные группы, поскольку на реакционном центре (С-атоме карбонильной группы) имеется дефицит электронов, эти превращения могут быть отнесены к SN реакциям.
Для ацилгалогенидов характерна большая полярность связей, что вызвано электроноакцепторным действием атома галогена.
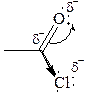
Электронная плотность на углеродном атоме карбоксильной группы сильно занижена. Ацилгалогениды обладают сильными электрофильными свойствами.
Химические свойства.Хлорангидриды применяются в качестве ацилирующих средств для введения ацильного радикала в различные классы органических соединений.
1. Гидролиз:
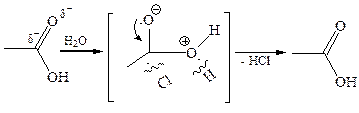
2. Алкоголиз:
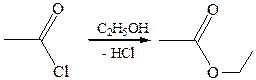
3. Ацидолиз:
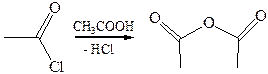
4. Аммонолиз:
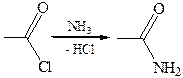
5. Получение пероксидов ацилов. Перекись ацила образуется при взаимодействии растворов хлористого ацетила в эфире или пентане с пероксидом водорода и гидроксидом натрия или с пероксидами металлов (пероксидами натрия или бария):
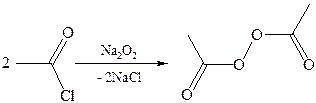
6. Реакции с алкоголятом натрия и ацетатом серебра:
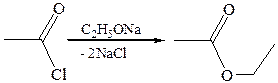
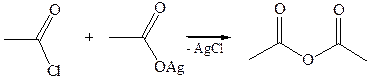
4.2.2.2 АНГИДРИДЫ КИСЛОТ –ангидриды кислот можно рассматривать как продукты межмолекулярной дегидратации кислот. Однако реакция дегидратации протекает только в жестких условиях, и чаще всего ангидриды получают реакцией ацилирования солей карбоновых кислот хлорангидридами, при этом может быть получен и смешанный ангидрид.
Ангидриды карбоновых кислот – бесцветные жидкости или кристаллические вещества. Ангидриды низших карбоновых кислот – жидкости с резким запахом, кипящие при температуре более высокой, чем соответствующие им кислоты. Ангидриды плохо растворимы в воде. Водный раствор уксусного ангидрида медленно гидролизируется.