рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ
Реферат Курсовая Конспект
ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ
ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ - раздел Химия, Общие...
ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ
Так, например, весьма вероятно, что реакции на карбонильную группу с аминосоединениями происходят по следующей схеме:ОКСОСОЕДИНЕНИЯ
Если карбонильная группа связана с одним водородным атомом и одним углеродным атомом (в простейшем случае с двумя водородными атомами), соединения… Если карбонильная группа связана с двумя углеродными атомами, соединения… Общая формула предельных карбонильных соединений СnН2nО.Классификация карбонильных соединений
Карбонильные соединения подразделяют в зависимости от:
· числа карбонильных групп в молекуле и присутствия других функциональных групп:
– монокарбонильные соединения;
– дикарбонильные соединения;
– карбонильные соединения с другими функциональными группами.
· типа углеродного атома, соединенного с карбонильной группой;
· природы других функциональных групп (галогенкарбонильные соединения, гидроксикарбонильные соединения, аминокарбонильные соединения и др.);
· строения углеводородных радикалов:
– алифатические;
– алициклические;
– ароматические.
К карбонильным соединениям относят хиноны – шестичленные циклические соединения с двумя карбонильными группами и двумя двойными связями в цикле.
Номенклатура альдегидов и кетонов.Для названия оксосоединений используют следующие номенклатуры:
· тривиальную;
· рациональную;
· систематическую.
Основные положения номенклатуры изложены в части 1, главе 4, примеры названий приведены в таблицах 19, 20.
Таблица 19 – Названия альдегидов по различным номенклатурам
| Формула | Номенклатура | ||
| тривиальная | рациональная | систематическая | |
| НСHO | муравьиный альдегид | формальдегид | метаналь |
| CН3СHO | уксусный альдегид | ацетальдегид | этаналь |
| CН3CН2СHO | пропионовый альдегид | метилацетальдегид, метилуксусный альдегид | пропаналь |
| CН3(CН2)2СHO | масляный альдегид | этилацетальдегид, этилуксусный альдегид | бутаналь |
| CН3CН(CН3)СHO | изомасляный альдегид | диметилаце-тальдегид, диметилуксусный альдегид | 2-метил-пропаналь |
| CН3(CН2)3СHO | валериановый альдегид | пропилацетальдегид, пропилуксусный альдегид | пентаналь |
| CН3 CН(CН3)CН2СHO | изовалериановый альдегид | изопропилаце-тальдегид, изопропилуксусный альдегид | 3-метил-бутаналь |
| C(CН3)3СHO | пиваловый альдегид | триметилаце-тальдегид, триметилуксусный альдегид | 2,2-диметил- пропаналь |
| C6Н5СHO | – | бензойный альдегид | бензальдегид |
| CН2 = CНСHO | акролеин | – | пропен-2-аль |
| CН3CН2 = CНСHO | кротоновый альдегид | – | бутен-2-аль |
| C6Н5CН = CНСHO | коричный альдегид | – | 3-фенилпропаналь |
Таблица 20 – Названия кетонов по различным номенклатурам
| Формула | Номенклатура | ||
| тривиальная | рациональная | систематическая | |
| CН3СOCН3 | ацетон | диметилкетон | пропанон |
| CН3СOCН2CН3 | – | метилэтилкетон | бутанон |
| CН3СO(CН2)2CН3 | – | метилпропилкетон | пентанон-2 |
| CН3СOCН(CН3)2 | – | метилизопропил-кетон | 3-метил-бутанон-2 |
| CН3CН2СOCН2CН3 | – | диэтилкетон | пентанон-3 |
| CН2 = C = O | кетен | – | – |
Изомерия альдегидов и кетонов.Для карбонильных соединений различают следующие виды изомерии:
Структурная:
· скелетная;
· изомерия положения (для кетонов);
· метамерия, в том числе изомерия функциональной группы.
Пространственная:
· оптическая.
Методы получения альдегидов и кетонов. Большинство карбонильных соединений не может быть получено из природного сырья вследствие низкого их содержания в растительных и животных организмах. Из традиционных эфирных масел, таких как цитронелловое и лимонное, получают ненасыщенные альдегиды, используемые в парфюмерной промышленности. Из коричного масла выделяют коричный альдегид. Главной составной частью эфирных масел, выжимаемых из ядер косточек горького миндаля, персиков, вишен и других плодов, является бензальдегид, содержащийся в виде гликозида амигдалина C6H5–CH(CN)–O–C12H21O10, который при гидролизе превращается в бензойный альдегид, синильную кислоту и дисахарид. Одно из веществ, ответственных за аромат черники – (Е)-гексен-2-аль, основное душистое вещество природного мускуса – мускон (S)-3-метилциклопентадеканон. Бутадион-2,3 входит в состав душистых веществ коровьего масла. Ферромоны некоторых видов чешуекрылых представляют собой несопряженные ненасыщенные альдегиды с прямой углеродной цепью.
1. Реакции окисления непредельных соединений (часть 1, главы 8.2–8.4).
2. Реакции окисления и дегидрирования оксисоединений соединений (часть 2, глава 3.1)
Технические способы получения формальдегида
3.2 Каталитическое окисление метана:Специфические методы для ароматического ряда
Окислятся кислородом в присутствии солей кобальта или марганца могут и другие…Реакции нуклеофильного присоединения
где Х = Н, Alk4.1
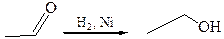
4.2
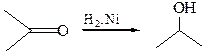
4.3 Метод Клеменсена (1913 г.). Восстановление карбонильной группы активными металлами (или амальгамами) в кислой среде приводит к образованию углеводородов:
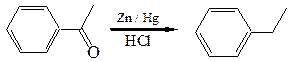
4.4 Восстановление по Кижнеру-Вольфу (1911 г.). Прямое нагревание оксосоединения с гидразином и КОН в высококипящем полярном растворителе:
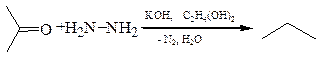
4.5 Восстановление комплексными гидридами металлов (NaBН4, LiAlН4). Реакции восстановления карбонильной группы гидридами металлов по механизму могут быть отнесены к типичным AN реакциям:
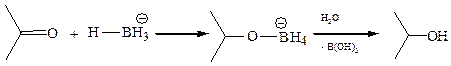
Атакующей частицей служит анион BН4– (или AlН4–), который и переносит гидрид-ион на карбонильный атом углерода. Главное достоинство этих реагентов по сравнению с другими заключается в том, что они содержат много активного водорода в малом количестве вещества. Так, в случае LiAlН4 для восстановления используются все четыре атома водорода.
4.5.1 Алюмогидрид лития – мощный и поэтому недостаточно селективный восстановитель. В его присутствии восстанавливаются параллельно с карбонильной группой и кратные связи, группы –NO2, –ON, сложно-эфирные группы –COOR, сопряженные с карбонильной группой:
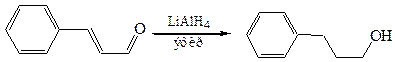
4.5.2 Борогидрид натрия – более мягкий восстановитель, селективно восстанавливающий карбонильные группы, не затрагивающий сопряженные с ними двойные связи. Это позволяет получать дефицитные ненасыщенные спирты:
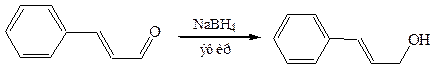
Реакции окисления альдегидов и кетонов
Для окисления альдегидов могут быть использованы не только обычные окислительные реагенты (КМnO4, СrО3), но и такие…5.1.1
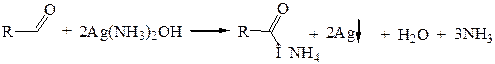
5.1.2
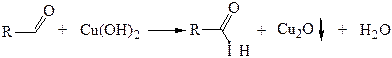
В этих реакциях альдегиды выступают в качестве восстановителей, восстанавливая ион серебра до металлического серебра (реакция «серебряного зеркала») и ион Сu2+ до оксида меди (I) Сu2О красного цвета. Обе реакции известны как качественные пробы на альдегидную группу.
5.1.3 Окисление ароматических альдегидов. В отличие от алифатических, очень легко окисляются кислородом воздуха на свету через стадию образования стабильного ароильного радикала:

5.2 Окисление кетонов требует более жестких условий и окислителей, например, хромовая смесь, щелочной раствор перманганата калия. В кислой или щелочной среде происходит енолизация кетона, а затем окисление с разрывом кратной связи енола. Поскольку у кетонов переход в енольную форму возможен по двум направлениям, то в результате окисления происходит разрыв связей С–С по обе стороны от кетонной группы (окислительное расщепление) Это приводит у несимметричных кетонов к образованию смеси четырех карбоновых кислот с меньшим числом атомов углерода:
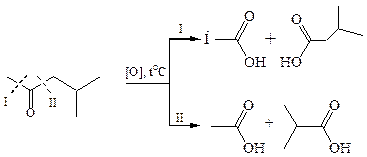
5.2.1 Окисление циклических кетонов:
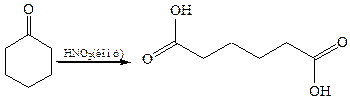
5.2.2 Окисление по α-положению. При этом не затрагиваются альдегидная группа и не разрушается связи С–С у кетонов. Например, известно, что оксид селена (IV) способен селективно окислять метальные или метиленовые группы, связанные с карбонилом, образуя α-кетоальдегиды или α-дикетоны:
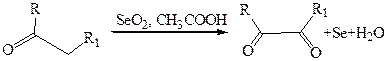
Реакции окисления-восстановления (диспропорционирования)
Реакция Канниццаро – окислительно-восстановительный процесс (диспропорционирование), протекающий под действием концентрированного водного или…КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
Классификация карбоновых кислот. Карбоновые кислоты подразделяются в зависимости: · от числа карбоксильных групп; · природы углеводородного заместителя (насыщенные, ненасыщенные или ароматические).МОНОКАРБОНОВЫЕ КИСЛОТЫ
Классификация.Монокарбоновые кислоты обычно подразделяют в зависимости от природы углеводородного остатка: · насыщенные; · ненасыщенные;Изомерия
· скелетная; · метамерия Пространственная:6.1
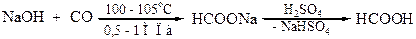
|
6.2
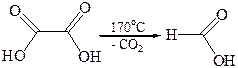
Физические свойства. Структура, температура кипения, межмолекулярные водородные связи. Низшие монокарбоновые кислоты (С1 – С4) представляют собой бесцветные жидкости, высшие алифатические и ароматические кислоты – твердые вещества. Первые гомологи – муравьиная, уксусная и пропионовая кислоты – обладают резким раздражающим запахом, при попадании на слизистые оболочки вызывают ожоги; с водой смешиваются в любых соотношениях.
Молекулы карбоновых кислот полярны и, подобно молекулам спиртов, могут образовывать водородные связи друг с другом и с молекулами других типов. Карбоновые кислоты имеют весьма высокие температуры кипения, что свидетельствует о значительной межмолекулярной ассоциации вследствие образования межмолекулярных водородных связей, причем образуются как циклические димеры, так и линейные олигомеры:

| 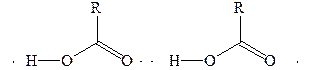
|
Таблица 24 – Физические свойства монокарбоновых кислот
| № | Название кислоты | Формула | Тпл, °С | Ткип, °С |
| Муравьиная | 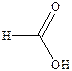
| 8,4 | 100,7 | |
| Уксусная | 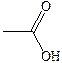
| 16,7 | 118,1 | |
| Пропионовая | 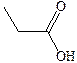
| –22 | 141,1 | |
| Масляная | 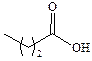
| –6,5 | 163,5 | |
| изо-Масляная | 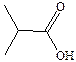
| –47 | 154,4 | |
| Продолжение таблицы 24 | ||||
| Валериановая | 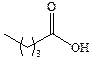
| –34,5 | ||
| Капроновая | 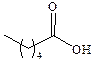
| –9,5 | ||
| Энантовая | 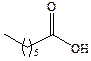
| –10 | 223,5 | |
| Каприловая | 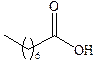
| 237,5 | ||
| Пеларгоновая | 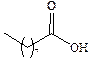
| 21,3 | ||
| Каприновая | 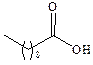
| 31,2 | ||
| Пальмитиновая | 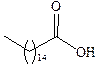
| |||
| Маргариновая | 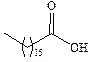
| 61,2 | – | |
| Стеариновая | 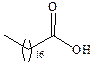
|
Электронное строение карбоксильной группы. Электронно-графическое изучение карбоновых кислот показало, что в их молекуле связь С=О длиннее, чем в кетонах, а связь С–О короче, чем в спиртах.
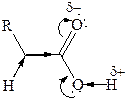
|
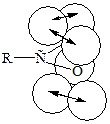
Это свидетельствует о взаимодействии электронных систем атома кислорода и С=О группы:
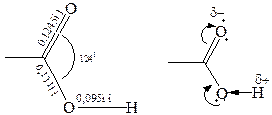
|
НЭП кислородного атома гидроксильной группы взаимодействует с π-электронами карбонильной группы – π,р-сопряжение, создающее условие для делокализации связей (+М). Это увеличивает полярность связи О–Н, но в то же время уменьшает положительный заряд по сравнению с карбонильными соединениями на углеродном атоме. Одновременно действует индуктивный эффект (–I) кислородных атомов. Следовательно, в карбоксильной группе имеются сильно поляризованные атомы Н и С, которые являются электрофильными центрами, и НЭП двух кислородных атомов, которые являются нуклеофильными центрами. Предполагают, что кислородный атом карбонильной группы имеет более нуклеофильный характер.
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н. В водном растворе карбоновые кислоты диссоциируют на ионы:
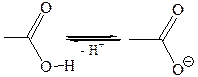
Кислоты, приведенные в таблице 24, значительно отличаются по своей силе. Муравьиная кислота и почти все α-замещенные уксусные кислоты сильнее, чем уксусная кислота. Так, трифторуксусная кислота сравнима по своей силе с соляной кислотой. Очевидно, что природа групп, находящихся поблизости от углеродного атома карбоксила, оказывает чрезвычайно большое влияние на силу кислоты.
Причиной легкой диссоциации карбоновых кислот является резонансная стабилизация карбоксилат-аниона. Если частица может быть представлена в виде нескольких резонансных форм, можно утверждать о ее относительно высокой стабильности, а чем более устойчивы продукты, тем легче протекает химическая реакция.
Электронное строение карбоксилатаниона. Согласно теории резонанса, карбоксилат-ион представляет собой гибрид двух структур, обладающих одинаковой стабильностью и, следовательно, одинаковым вкладом в результирующую структуру. Атом углерода связан с каждым из атомов кислорода одной «полуторной» связью. Отрицательный заряд равномерно распределен между двумя атомами кислорода:
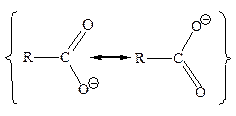
| ≡ | 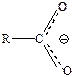
|
Анион представляет собой резонансный гибрид, что подтверждается данными по длинам связей:
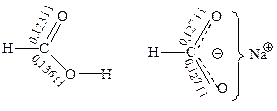
Электроны в резонансном гибриде связаны не с одним или двумя ядрами, а с тремя ядрами одновременно (один углерод и два кислорода), поэтому они прочнее удерживаются, связи становятся сильнее и анион – устойчивее. Именно такое участие электронов в образовании более чем одной связи, или, иными словами, делокализация («размазывание») электронного облака, и подразумевается в структуре, представляющей анион как резонансный гибрид двух структур:
Химические свойства. Общая характеристика реакционной способности. В карбоксильной группе благодаря +М эффекту происходит перераспределение электронной плотности – на кислородном атоме ОН–группы она понижается по сравнению со спиртами, а на углеродном атоме – повышается по сравнению с обычными оксосоединениями. Это приводит к изменению реакционной способности и гидроксила, и карбонильной группы:
· уменьшение электронной плотности на кислородном атоме гидроксильной группы снижает нуклеофильность кислот. Кроме того, это умень- шение приводит к дополнительному смещению электронов связи О–Н и соответственно – к увеличению полярности этой связи. Поэтому водород менее прочно связан с атомом кислорода и отщепляется легче, чем у спиртов, т. е. повышается кислотность ОН-группы и резко уменьшается основность гидроксильного кислорода;
· увеличение электронной плотности на углеродном атоме делает его менее доступным для нуклеофильной атаки. Поэтому С=О группа в карбоксиле практически потеряла способность вступать в реакции с нуклеофильными реагентами (могут реализоваться только некоторые АN реакции).
Таким образом, карбоксильная группа не является простой суммой свойств карбонила и гидроксила, а представляет собой новую функциональную группу с особыми, присущими ей свойствами.
Для карбоновых кислот характерны следующие типы реакций:
· реакции, связанные с кислотными свойствами, сопровождающиеся разрывом связи О–Н;
· реакции нуклеофильного замещения ОН-группы;
· реакции по углеводородному остатку, приводящие к образованию замещенных карбоновых кислот.
Следует также отметить, что карбоновые кислоты термически стабильны, трудно окисляются и трудно восстанавливаются.
Кислотные свойства. Карбоновые кислоты могут проявлять О–Н кислотность, причем значительно большую, нежели спирты и фенолы. Повышенная кислотность карбоновых кислот может быть объяснена следующим образом:
· связь О–Н в кислотах обладает большей полярностью благодаря +М эффекту в карбоксильной группе. Подобного рода эффект наблюдается и у фенолов. Однако смещение р-электронов в карбоксильной группе сильнее, чем в фенолах, поскольку на углеродном атоме карбонильной группы имеется дефицит электронов;
· связь О–Н в кислотах имеет меньшую энергию диссоциации, поскольку при ее разрыве образуется карбоксилат-анион (ацилат-анион), стабилизированный благодаря полной делокализации отрицательного заряда. О полном выравнивании электронной плотности свидетельствует равноценность обеих связей С–О в карбоксилат-ионе.
Карбоновые кислоты значительно более сильные кислоты, чем спирты, фенолы и угольная кислота, однако уступают сильным минеральным кислотам. На силу карбоновых кислот оказывает значительное влияние природа радикала, связанного с карбоксильной группой. ЭА заместитель увеличивает полярность связи О–Н, стабилизирует образующийся карбоксилат-анион и тем самым усиливает кислотный характер молекулы. ЭД за- местители, наоборот, снижают полярность связи О–Н, дестабилизируют карбоксилат-анион, что приводит к уменьшению кислотных свойств.
Реакции карбоновых кислот с нуклеофильными реагентами
1.2 Взаимодействие с оксидами металлов:ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
Способы получения
2. Взаимодействие с тионилхлоридом:Способы получения
1. Ацидолиз карбоновых кислот:
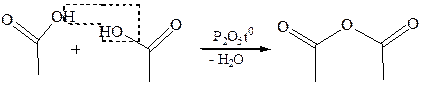
Химические свойства
4.2.2.3 АМИДЫ КАРБОНОВЫХ КИСЛОТ– функциональные производные кислот, в которых гидроксил карбоксильной группы замещен…Способы получения амидов
2. Ацилирование аминов:Химические свойства
1.1 В кислой среде:3.1
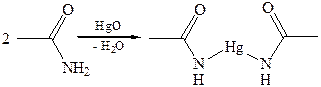
3.2
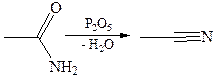
4. Дегидратация амидов:
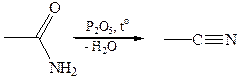
5. Восстановление амидов:
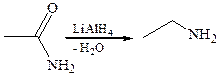
4.2.2.4 СЛОЖНЫЕ ЭФИРЫ КАРБОНОВЫХ КИСЛОТ – функциональные производные кислот, в которых гидроксил карбоксильной группы замещен на алкоксигруппу. Это замещение можно осуществить при взаимодействии карбоновой кислоты со спиртом, которое называется реакцией этерификации.
Способы получения
Механизм этерификации:Химические свойства
1.1 Щелочной гидролиз:ДИКАРБОНОВЫЕ КИСЛОТЫ
· насыщенные; · ненасыщенные; · ароматические.Общие способы получения дикарбоновых кислот
3.1
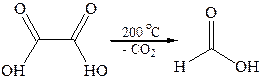
3.2
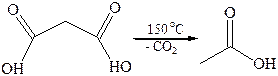
Декарбоксилирование щавелевой кислоты используется как лабо-раторный метод синтеза муравьиной кислоты. Декарбоксилирование производных малоновой кислоты является важным этапом в синтезе карбоновых кислот. Декарбоксилирование ди- и трикарбоновых кислот характерно для многих биохимических процессов.
По мере удлинения углеродной цепи и удаления функциональных групп ослабевает их взаимное влияние. Поэтому следующие два члена гомологического ряда – янтарная и глутаровая кислоты – при нагревании не декарбоксилируются, а теряют молекулу воды и образуют циклические ангидриды. Такой ход реакции обусловлен образованием устойчивого пяти- или шестичленного цикла.
3.3
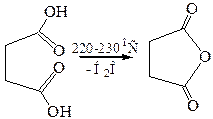
3.4 Прямой этерификацией кислоты могут быть получены ее полные эфиры, а взаимодействием ангидрида с эквимольным количеством спирта – соответствующие кислые эфиры:
3.4.1
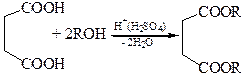
3.4.2
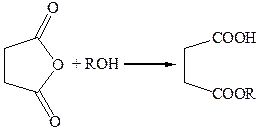
3.5 Получение имидов. Нагреванием аммонийной соли янтарной кислоты получают ее имид (сукцинимид). Механизм этой реакции такой же, как при получении амидов монокарбоновых кислот из их солей:
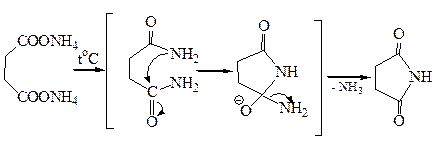
В сукцинимиде атом водорода в иминогруппе обладает значительной протонной подвижностью, что вызвано электроноакцепторным влиянием двух соседних карбонильных групп. На этом основано получение N-бром-сукцинимида – соединения, широко используемого в качестве бромирую-щего агента для введения брома в аллильное положение:
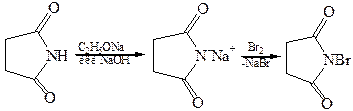
Отдельные представители. Щавелевая (этандновая) кислота НООС–СООН. В виде солей содержится в листьях щавеля, кислицы, ревеня. Соли и эфиры щавелевой кислоты имеют тривиальное название оксалаты. Щавелевая кислота проявляет восстановительные свойства:
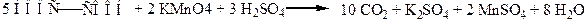
Эта реакция используется в аналитической химии для установления точной концентрации растворов перманганата калия. При нагревании в присутствии серной кислоты происходит декарбоксилирование щавелевой кислоты с последующим разложением образовавшейся муравьиной кислоты:
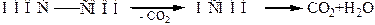
Качественной реакцией для обнаружения щавелевой кислоты и ее солей служит образование нерастворимого оксалата кальция.
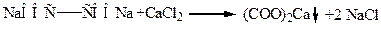
Щавелевая кислота легко окисляется, количественно превращаясь при этом в диоксид углерода и воду:
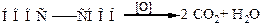
Реакция настолько чувствительна, что ее используют в объемном анализе для установления титров растворов перманганата калия.
Малоновая (пропандиовая) кислота НООС–СН2–СООН. Содержится в соке сахарной свеклы. Малоновую кислоту отличает значительная протонная подвижность атомов водорода в метиленовой группе, обусловленная электроноакцепторным влиянием двух карбоксильных групп.
Водородные атомы метиленовой группировки настолько подвижны, что могут замещаться на металл. Однако со свободной кислотой это превращение невозможно, так как водородные атомы карбоксильных групп значительно подвижнее и замещаются в первую очередь.
Заместить α-водородные атомы метиленовой группы на натрий возможно, лишь защитив карбоксильные группы от взаимодействия, что позволяет сделать полная этерификация малоновой кислоты:
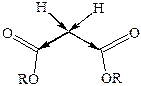
Малоновый эфир при взаимодействии с натрием, отщепляя водород, образует натрий-малоновый эфир:
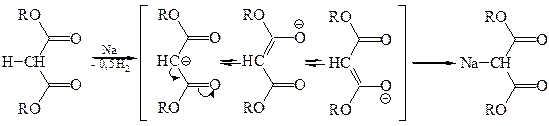
Анион Na-малонового эфира стабилизирован сопряжением НЭП атома углерода с π-электронами связей С=О. Na-малоновый эфир, как нуклеофил, легко вступает во взаимодействие с молекулами, содержащими электрофильный центр, например, с галогеналканами:
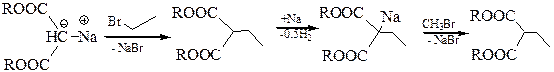
Пречисленные реакции позволяют использовать малоновую кислоту для синтеза ряда соединений:
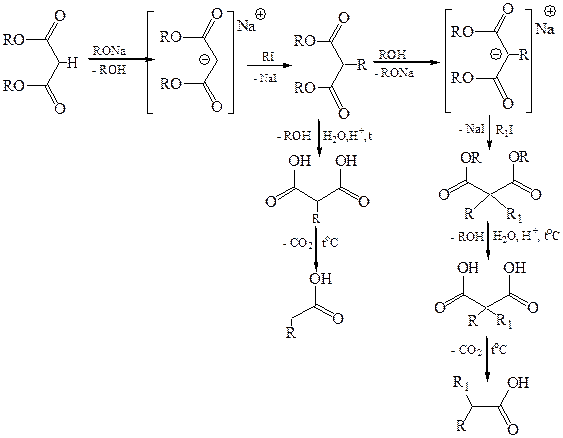
Янтарная кислота представляет собой бесцветное кристаллическое вещество с т. пл. 183 °С, растворяется в воде и спиртах. Янтарная кислота и ее производные достаточно доступны и находят широкое применение в органическом синтезе.
Адипиновая (гександиовая) кислота НООС–(СН2)4–СООН. Представляет собой бесцветное кристаллическое вещество с т. пл. 149 °С, мало растворима в воде, лучше – в спиртах. Большое количество адипиновой кислоты идет на изготовление полиамидного волокна нейлона. Благодаря своим кислотным свойствам адипиновая кислота используется в быту для удаления накипи с эмалированной посуды. Она реагирует с карбонатами кальция и магния, переводя их в растворимые соли, и в то же время не портит эмаль, как сильные минеральные кислоты.
4.2.4 НЕПРЕДЕЛЬНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
4.2.4.1 ОДНООСНОВНЫЕ КИСЛОТЫ ЭТИЛЕНОВОГО РЯДА
Соединения содержащие двойную связь С=С, сопряженную с карбоксильной группой в кислотах и их прозводных менее стабильны, чем α, β-ненасыщенные оксосоединения. Предполагают, что в этих молекулах имеет место «перекрестное» сопряжение, которое менее эффективно стабилизирует систему, чем линейное сопряжение в молекулах α, β-ненасыщенных карбонильных соединениях:
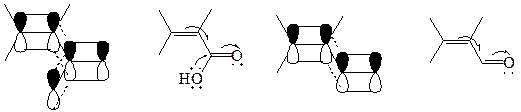
Классификация.Непредельные карбоновые кислоты в зависимости от природы углеводородного остатка:
· насыщенные;
· ненасыщенные;
· аренмонокарбоновые.
Номенклатура непредельных карбоновых кислот:
· тривиальная;
· систематическая.
Изомерия
· скелетная; · изомерия положения; · метамерия.1.
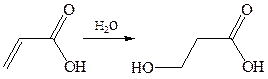
2.
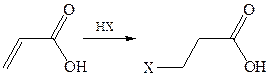
Отсутствие прямых доказательств 1,4-присоединения к α,β-непредель-ным кислотам позволяет рассматривать присоединение воды, аммиака и галоидоводорода как антимарковниковское 1,2-присоединение по олефиновой связи. Реакция начинается с нуклеофильной атаки аниона по одному из углеродов связи, обедненной электронами, а именно по β-углероду.
4. Реакция Михаэля. Частным случаем этой реакции является присоединение в сильнощелочной среде ацетоуксусного и малонового эфиров, ацетилацетона или подобных соединений к α,β-непредельным кислотам и их производным:
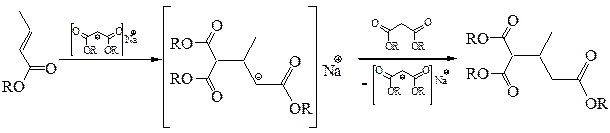
5. Изомеризация. При нагревании со щелочью соли винилуксусной кислоты переходят в соли кротоновой кислоты:
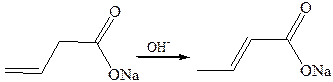
6. Полимеризация. Кислоты и их производные типа CH2=CR–СООН легко полимеризуются по гемолитическому механизму (инициаторы – перекиси и другие генераторы свободных радикалов). Полимеры акрилатов и акрилонитрила, как все «виниловые полимеры», имеют структуру следующего типа:
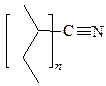
| 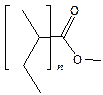
|
| полиакрилонитрил | полиметилакрилат |
Стеклопласты– пластические массы, у которых связующим веществом служат синтетические полимеры, а наполнителем или армирующим материалом – стеклянное волокно или стеклянная ткань, придающие стеклопластикам особую прочность. Большинство изделий из стеклопластиков изготавливают с применением в качестве связующих ненасыщенных полиэфиров – полиэфирмалоинатов или полиэфиракрила-тов, а также эпоксидных и кремнийорганических полимеров.
Стеклопластики применяются для изготовления таких крупногабаритных изделий, как корпуса мелких судов, шлюпки, кузова автомобилей, крыши железнодорожных вагонов и т. п. В зависимости от вида армирующего материала стеклопластики делятся на следующие группы:
· Стеклотекстолиты – пластики, армированные стеклянными тканями. Изделия получаются обычно методом «контактного» формования.
· Стекловолокниты – пластики, в которых армирующим наполнителем служит войлок из стеклянного волокна. Перерабатываются методом литья или прессования.
· Анизотропные стеклопластики – пластики с армирующим материалом в виде однонаправленной стеклянной нити. Изделия получают методом намотки стеклянного волокна, предварительно обработанного синтетическим полимером.
· Изотропные стеклопластики – пластики, армированные стекломатами (рубленое стеклянное волокно). Перерабатываются методом контактного формования.
· Стеклопласты – материалы, полученные из синтетических смол и наполнителей. В качестве наполнителя используются стекловолокнистые материалы.
4.2.4.2 НЕПРЕДЕЛЬНЫЕ ДИКАРБОНОВЫЕ КИСЛОТЫ
К непредельным дикарбоновым кислотам относятся функционально замещенные непредельные углеводороды, содержащие две карбоксильные группы.
Номенклатура непредельных дикарбоновых кислот. Спецификой номенклатуры непредельных дикарбоновых кислот является широкое применение в обиходе:
· тривиальная;
· систематическая.
Примеры названий непредельных дикарбоновых кислот приведены в таблице 29.
Таблица 29 – Названия непредельных дикарбоновых кислот
| Формула | Номенклатура | |
| Тривиальная | ИЮПАК | |
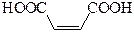
| Малеиновая | цис-Бутендиовая |
| Продолжение таблицы 29 | ||
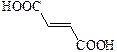
| Фумаровая | транс-Бутендиовая |
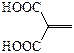
| – | 2-метилиденпропандиовая |
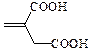
| Итаконовая | Пропен-2-дикарбоновая |

| – | Бутиндиовая |
Методы получения
1. Дегидрогалогенирование. Для получения ненасыщенных дикарбоновых кислот чаще всего используют методы введения двойной или тройной связи в молекулу насыщенной дикарбоновой кислоты или введения карбоксильных групп в ненасыщенное соединение:
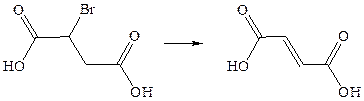
2. Дегидратация:
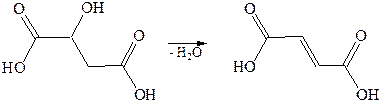
3. Дегалогенирование:
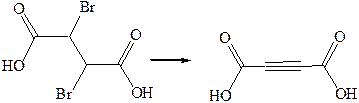
4. Окисление:
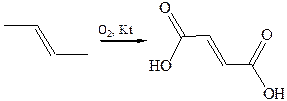
Химические свойства. Ненасыщенные дикарбоновые кислоты являются более сильными кислотами по сравнению с насыщенными, так как взаимное влияние двух карбоксильных групп по системе π-связей переносится сильнее. Следует обратить внимание на значения второй константы ионизации малеиновой и итаконовой кислот. Низкая кислотность моноаниона свидетельствует о сильном внутримолекулярном взаимодействии неионизированной и ионизированной карбоксильных групп. Значения рКа (Н2О) некоторых ненасыщенных дикарбоновых кислот приведены в таблице 30.
Таблица 30 – Значения рКа (Н2О) ненасыщенных дикарбоновых кислот
| Кислота | рКа1 | рКа2 | рКа2 – рКа1 |
| малеиновая | 1,92 | 6,23 | 4,31 |
| фумаровая | 3,02 | 4,32 | 1,30 |
| итаконовая | 3,82 | 5,66 | 1,82 |
| ацетилендикарбоновая | 1,73 | 4,40 | 2,67 |
Наиболее важными и интересными представителями этого ряда соединений являются два геометрических изомера бутендиовой кислоты. Один из них (транс-изомер) обнаружен в лишайниках и грибах, а также в повилике (дымянка, Eumarie officinalis) и в соответствии с природным источником был назван фумаровой кислотой; другой (цис-изомер) в природе не встречается и получил название малеиновой кислоты. Как и все цис-транс-изомеры, фумаровая и малеиновая кислоты отличаются по физико-химическим свойствам и достаточно легко могут быть выделены из смеси.
Цис-изомер более полярен и поэтому должен лучше растворяться в полярном растворителе, например, в воде. С другой стороны, большая степень взаимодействия сближенных карбоксильных групп должна приводить к напряжению связей и повышению энергии молекулы, что обнаруживается в более высокой величине теплоты сгорания цис-изомера. Превращение изомеров возможно при облучении ультрафиолетовым светом или нагревании до температуры порядка 150 °С.
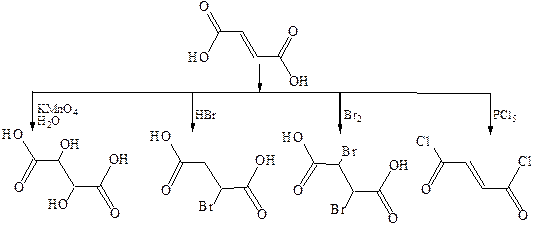
Малеиновая и фумаровая кислоты обнаруживают обычные свойства карбоновых кислот и непредельных соединений. По карбоксильной группе могут быть получены производные кислот. Как непредельные соединения, малеиновая и фумаровая кислоты обесцвечивают бромную воду и водно-щелочной раствор перманганата калия, а также присоединяют галогеноводороды, воду, водород и т. п.
Малеиновая и фумаровая кислоты – пример того, что цис- и транс-изомеры могут обнаруживать различия в химических свойствах. Действительно, малеиновая кислота способна образовывать внутримолекулярный ангидрид при нагревании с пентаоксидом фосфора, тогда как фумаровая кислота своего ангидрида не образует:
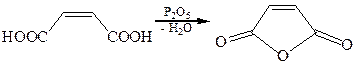
Фумаровая кислота используется как подкислитель, обладает бактерицидными и антисептическими свойствами. Она также может использоваться как регулятор кислотности, ускоритель консервирования и приправа. Используется как кислое вещество в шипучих продуктах и придает тягучесть и остроту жевательным резинкам. В фармацевтике ее применяют как вспомогательное и зрительно придающее белизну вещество, а также для получения фумарата железа.
Малеиновую кислоту применяют в пищевой промышленности как средство против прогоркания жиров, масел и сухого порошкового молока. Кроме того, малеиновый ангидрид применяют для получения полиэфирных полимерных материалов.
4.2.5 ЖИРЫ
Природные животные жиры и растительные масла состоят главным образом из глицеридов (сложные эфиры глицерина и органических кислот, С10 – С18). Наблюдаемые различия между жирами обусловлены исключительно органическими кислотами. Запасные жиры – один из метаболических энергетических резервов живых систем.
Кислоты жиров. Кислоты в природных жирах являются монокарбоновыми с нормальной цепью и четным числом атомов углерода. Исключение составляют изовалериановая кислота и ряд циклических кислот, содержащихся в некоторых редко встречающихся жирах.
Природные жиры классифицируют на основании содержащихся в них главных кислот (таблица 31).
Из всех непредельных кислот, содержащихся в природных жирах, наиболее распространена олеиновая кислота, две другие непредельные кислоты – линолевая и линоленовая – присутствуют в значительно меньшем количестве. В заметных количествах линолевая и линоленовая кислоты содержатся в растительных маслах; для животных организмов они являются незаменимыми кислотами. В природе непредельные кислоты встречаются только в цис-форме.
Таблица 31 – Классификация карбоновых кислот жиров
| Кислота | Число атомов углерода | Формула | |
| Предельные (жирные) кислоты | |||
| Капроновая | С6 | 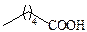
| |
| Каприловая | С8 | 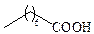
| |
| Каприновая | С10 | 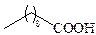
| |
| Лауриновая | С12 | 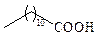
| |
| Миристиновая | С14 | 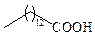
| |
| Пальмитиновая | С16 | 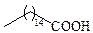
| |
| Стеариновая | С18 | 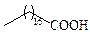
| |
| Арахиновая | С20 | 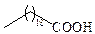
| |
| Непредельные кислоты | |||
| Олеиновая | С18 | 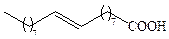
| |
| Линолевая | С18 | 
| |
| Линоленовая | С18 | 
| |
| Элеостеариновая | С18 | 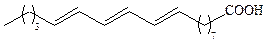
| |
| Эруковая | С22 | 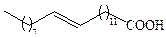
| |
Пальмитиновая, стеариновая и миристиновая кислоты распространены так же, как и олеиновая. Стеариновая кислота содержится в большом количестве в запасных жирах некоторых млекопитающих и в жирах некоторых тропических растений, например, в масле какао.
Жиры «низших живых существ» (бактерий) отличаются по своему составу от жиров высших живых существ (млекопитающих) – состав последних обычно значительно сложнее.
Химические свойства жиров
ОСОБЕННОСТИ ФИЗИЧЕСКИХ СВОЙСТВ ГОМО-ФУНКЦИОНАЛЬНЫХ ПРОИЗВОДНЫХ УГЛЕВОДОРОДОВ
Галогенопроизводные углеводородов. Замещение атома водорода в углеводородах на галоген приводит к значительному изменению физических характеристик… Наиболее близкими к углеводородам по температуре кипения, плавления, плотности… Алкил- и ариламины обладают достаточно широким спектром физических свойств в зависимости от природы иколичества…ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ПРОИЗВОДСТВА И
ПРИМЕНЕНИЯ ГОМОФУНКЦИОНАЛЬНЫХ ПРОИЗВОДНЫХ
УГЛЕВОДОРОДОВ
При рассмотрении вопросов загрязнения окружающей среды экологически токсичными отходами следует учитывать два аспекта проблемы: · токсичность самих органических веществ; · токсичность органических и неорганических отходов, образующихся в ряде технологических процессов.– Конец работы –
Используемые теги: общие, закономерности, строения, химического, поведения, оксосоединений0.096
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ОБЩИЕ ЗАКОНОМЕРНОСТИ СТРОЕНИЯ И ХИМИЧЕСКОГО ПОВЕДЕНИЯ ОКСОСОЕДИНЕНИЙ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов