Теоретические сведения.
Понятие «химическое равновесие» применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции равна скорости обратной реакции
равна скорости обратной реакции 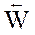 . Равенство
. Равенство  является кинетическим условием химического равновесия.
является кинетическим условием химического равновесия.
Химическое равновесие характеризуется постоянством величин энергии Гиббса системы GT. Равенство ΔGT = 0 является термодинамическим условием химического равновесия.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам, называется константой равновесия. Для обратимой реакции
Н2(г) + I2(г)↔2HI(г)
константа равновесия имеет вид
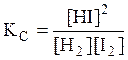 или
или 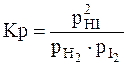 ,
,
где КС, КР – константы равновесия в случае отношения молярных концентраций и парциальных давлений соответственно; [HI], [H2], [I2] – равновесные молярные концентрации; ,
,  - парциальные давления.
- парциальные давления.
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в сиcтеме. Показывает на сколько скорость прямой реакции больше скорости обратной; характеризует глубину протекания процесса.
Константа равновесия связана со стандартной энергией Гиббса данной реакции (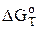 ) следующим соотношением
) следующим соотношением
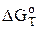 = -RTlnKС
= -RTlnKС
где R — универсальная газовая постоянная [8,31 Дж/(моль.К)]; Т — абсолютная температура, К; КС — константа равновесия.
Если КС>1 (ΔG<0), то в равновесной системе преобладают продукты реакции, а если КС<1 (ΔG>0), то в равновесной системе преобладают исходные вещества.
Химическое равновесие остается неизменным до тех пор, пока постоянны параметры (p,T,CM), при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
В общем случае, направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится в сторону, противодействующую этому воздействию.
1. При увеличении концентрации реагирующих веществ, равновесие сместится в сторону продуктов реакции, а при уменьшении концентрации исходных веществ – в сторону их образования.
2. При увеличении общего давления в системе равновесие смещается в сторону меньшего числа моль газообразных веществ, а при уменьшении – в сторону большего числа моль газообразных веществ.
3. Увеличение температуры в системе смещает равновесие в сторону эндотермической реакции, а уменьшение – в сторону экзотермической реакции.