ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходный раствор "А": 20%,  =0.97 г/см3
=0.97 г/см3
Заданные растворы: С1 = 5%, C2 = 6%, C3 = 7%
| ||
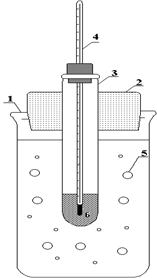
| Рис.4. Схема установки (криостата): | ||
| 1 - Стакан | ||
| 2 - Пробка | ||
| 3 - Пробирка | ||
| 4 - Термометр | ||
| 5 - Холодильная смесь | ||
| 6 - Заданный раствор | ||
Ход работы:
1. Приготовить 10 г заданного раствора.
Для этого, рассчитайте объем 20%-го раствора "A" и объем дистиллированной воды, необходимые для приготовления заданного раствора.
2. Заполнить приготовленным раствором пробирку так, чтобы шарик термометра был полностью погружен в раствор (смотри рис.4)
3. Заполнить стакан (криостат) холодильной смесью (на 100 г снега или льда - 29 г NH4Cl + 16 г KNO3).
4. Перемешивая раствор термометром*, произвести измерение температуры замерзания, для чего:
· Произвести замеры при понижении температуры до момента появления первых кристаллов льда в пробирке.
· Занести в таблицу величину температуры кристаллизации.
· Продолжить замеры температуры при уменьшении ее ниже точки кристаллизации. Снимать показания с термометра через каждые 30 секунд.
Результаты занести в таблицу.
| τ,мин | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 4,5 | 5,0 | 5,5 | 6,0 | 6,5 | |
| t,oC |
5. Если опыт не получился, то вынуть пробирку из криостата, нагреть ее до растворения кристаллов и сделать повторное измерение температуры замерзания согласно п.5.
6. Зарисовать график зависимости t(oC)-τ(мин). Подобрать масштаб таким образом, чтобы график получился красивым.
7. Произвести расчет:
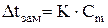 , ,
| где Сm - моляльная концентрация раствора, моль/кг |
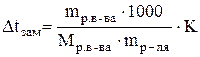 , ,
| где К - криоскопическая константа (справочная величина), К=1.86 |
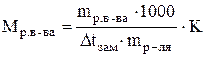
| где mр.в-ва= (w. mр-ра)/100 % mр-ля = mр-ра - mр.в-ва |
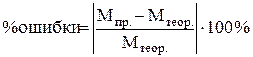
|
8. Сделать вывод.
*) Перемешивание необходимо для того, чтобы не попасть в область метастабильного состояния (см. Рис.7 точка А).