Законы электролиза.
Количественные соотношения при электролизе между выделившимся веществом и прошедшим через электролит электричеством выражаются двумя законами Фарадея.
I закон Фарадея. Количества веществ, выделяющихся на электродах при электролизе, прямо пропорциональны количеству электричества, прошедшего через электролит. Количество вещества, выделяющегося при прохождении через электролит 1 кулона электричества, называется электрохимическим эквивалентом (Э).
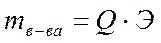
где Q – количество электричества, пропущенного через раствор или расплав электролита Q = I∙t,
где t - время, в сек., I - сила тока.

где МЭ - молярная масса эквивалента вещества, n - число электронов в электродном процессе. Т.о., получаем

II закон Фарадея. В последовательно соединенных электролизерах количества веществ, выделившихся на электродах при прохождении одинакового количества электричества, прямо пропорциональны их химическим эквивалентам.
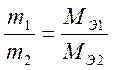 или
или 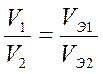
Следовательно, для восстановления на катоде и окисления на аноде одного моль-эквивалента любого вещества необходимо затратить одно и то же количество электричества, а именно 96487 кулонов. Эта константа называется числом Фарадея и обозначается буквой F.