Рb + РbO2 + 2Н2SO4= 2PbSO4 + 2Н2O
Электроны, отдаваемые атомами металлического свинца при окислении, принимаются атомами свинца РbО2 при восстановлении; электроны передаются от одного электрода к другому по внешней цепи.
Таким образом, металлический свинец служит в свинцовом аккумуляторе анодом и заряжен отрицательно, а РbО2 служит катодом и заряжен положительно.
Во внутренней цепи (в растворе H2SO4) при работе аккумулятора происходит перенос ионов. Ионы SO42- движутся к аноду, а ионы Н+ — к катоду. Направление этого движения обусловлено электрическим полем, возникающим в результате протекания электродных процессов: у анода расходуются анионы, а у катода — катионы. В итоге раствор остается электронейтральным.
Суммарная реакция в аккумуляторе:
2PbSO4 + 2Н2O 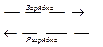 Рb + РbO2 + 2Н2SO4
Рb + РbO2 + 2Н2SO4
Лабораторная работа №15