Уравнение Бойля-Мариотта и Гей-Люссака
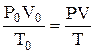 ;
;
где V – объем газа, измеренный при реальных условиях, т.е. при атмосферном давлении Р и температуре Т; V0 – объем газа при нормальном давлении Р0 и температуре Т0. Используют для приведения объема к нормальным условиям.
2. Закон Авогадро:в равных объемах разных газов при одинаковом давлении и температуре содержится одинаковое число молекул. В одном моле содержится 6,022·1023 молекул (число Авогадро).
При нормальных условиях(T= 273К, p = 101,325 кПа или 760 мм рт.ст.) моль любого газа занимает объем 22,4 л. Теперь несложно рассчитать молярные объемы эквивалентов наиболее распространенных в реакциях газов Н2 и О2. Один моль Н2 (2г) занимает объем 22,4 л, а один эквивалент Н2(1г) – V л, следовательно, Vэ(Н2) = 11,2 л/моль. Аналогичным образом рассчитывается Vэ(О2) = 5,6 л/моль.