Изоэлектрическая точка аминокислот
Если раствор аминокислоты поместить в электрическое поле, то в зависимости от кислотности или основности раствора будет наблюдаться различная картина. В сильнощелочном растворе концентрация анионов II превышает концентрацию катионов III и наблюдается миграция аминокислоты по направлению к аноду.
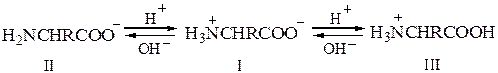
В сильнокислом растворе имеется значительный избыток катионов III и будет наблюдаться миграция аминокислоты к катоду. Если концентрации ионов II и III равны друг другу, то не будет наблюдаться никакого видимого движения; в этих условиях любая молекула одно и то же время проводит в состоянии и катиона и аниона, поэтому любое незначительное смещение в направлении одного из электродов немедленно компенсируется равным смещением в направлении другого электрода. Концентрация ионов водорода, при которой данная аминокислота не движется под влиянием электрического поля, называется изоэлектрической точкой данной аминокислоты.
Моноаминомонокарбоновая кислота H3N+CHRCOO– имеет несколько большую величину кислотности по сравнению с основностью (например, для глицина Ка — 1,6 · 10–10, а Кь = 2,5 · 10–12). Если кристаллы такой аминокислоты прибавить к воде, то образующийся раствор будет содержать больше анионов II (H2NCHRCOO–), чем катионов III (H3N+CHRCOOH). Эту «избыточную» ионизацию иона аммония в амин (I < = > II + Н+) можно подавить прибавлением кислоты для того, чтобы была достигнута изоэлектрическая точка, которая вследствие этого будет несколько сдвинута в область кислых значений рН. Например, для глицина изоэлектрическая точка лежит при рН 6,1. Аминокислота обычно обнаруживает самую низкую растворимость в растворе при изоэлектрической точке, поскольку при этом концентрация диполярного иона максимальна. Если же раствор будет более щелочным или более кислым, то тем самым увеличивается концентрация одного из более растворимых ионов (II или III).