Химические свойства
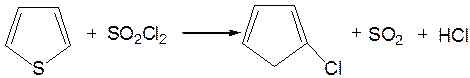
1. Реакция галогенирования. Для галогенирования тиофена можно использовать бром или хлор при низкой температуре, при этом могут образовываться как моно-, так и полигалогентиофены. Более избирательно действует сульфурилхлорид (SO2Cl2):
2. Реакция сульфирования.Повышенная устойчивость тиофена позволяет сульфировать его серной кислотой, причем, в отличие от бензола, тиофен сульфируется на холоде, что используется для очистки бензола от примесей тиофена:

3. Реакция нитрования.Хотя тиофен значительно устойчивее к действию минеральных кислот, чем фуран и пиррол, но и он окисляется азотной кислотой с разрушением молекулы. Поэтому для нитрования вышеназванных гетероциклов используют «мягкий» нитрующий агент – ацетилнитрит (смесь уксусного ангидрида с азотной кислотой) в пиридине, при этом образуются a-нитропроизводные:
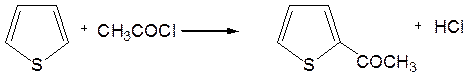
4. Реакция ацилирования.Реакцию ацилирования по Фриделю-Крафтсу проводят (подобно бензолу) в более жестких условиях:
5. Реакция гидрирования. Восстанавливается действием металлического натрия в спирте в присутствии аммиака, так как никелевые или платиновые катализаторы при гидрировании отравляются тиофеном и конечным продуктом гидрирования – тиофаном, который содержится в сернистых нефтях:
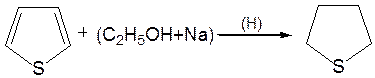
6. Реакция окисления.Тиофен в обычных условиях не окисляется. О термической устойчивости тиофена говорит сам факт его образования при температуре коксования угля (~1000°С).