Опыт 1. Аллотропия фосфора - раздел Химия, Закономерность изучается на примере взаимодействия тиосульфата натрия с серной кислотой В Цилиндрическую Пробирку Поместить Один Микрошпатель Сухого Порошка Красного...
В цилиндрическую пробирку поместить один микрошпатель сухого порошка красного фосфора. Закрыть пробирку ватой и закрепить в штативе в слегка наклонном положении. Нагреть пламенем горелки ту часть пробирки, где находится красный фосфор. Если в начале опыта в пробирке появится зелёное пламя вследствие воспламенения фосфора, продолжать нагревание, пламя скоро исчезнет благодаря малой циркуляции воздуха. Когда будет заметно уменьшение количества красного фосфора в пробирке и появление на ее стенках в холодной части белого налета оксидов фосфора и мелких капелек белого фосфора, прекратить нагревание. Не дожидаясь полного охлаждения пробирки, потереть стеклянной палочкой те места, где находятся частицы белого фосфора. Что происходит с белым фосфором, если палочку вынуть из пробирки? Какая из аллотропных модификаций фосфора химически более активна? В чем ”то проявилось? Написать уравнения реакций горения фосфора с образованием мономеров Р2О3 и Р2О5 (обычно оксиды фосфора образуются в виде димеров Р4О6 и Р4О10). После окончания опыта прилить в пробирку 5-6 капель раствора сульфата меди. Осторожно встряхнуть пробирку, чтобы омыть осадок со стенок. Отметить появление налета меди. Белый фосфор окисляется да фосфорной кислоты по схеме
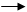 P+CuSO4+H2O H3PO4+H2SO4+Cu
P+CuSO4+H2O H3PO4+H2SO4+Cu
Примечание: В опытах с белым фосфором необходимо соблюдать крайнюю осторожность! Белый фосфор ядовит, кроме того, он может причинить сильные ожоги.
Все темы данного раздела:
Опыт 2. Влияние катализатора на скорость реакции
Каталитическое восстановление железа (III)
Выполнение работы. В две пробирки внести по 10 капель 0,5 н. раствора роданида калия и по
Опыт 3. Смещение химического равновесия обратимых реакций
Влияние концентрации реагирующих веществ на смещение равновесия
Выполнение работы. В четыре конические пробирки внести по 5—7 капель 0,0025 н. ра
Опыт 1 Определение плотности раствора ареометром.
Между плотностью раствора ρ и концентрацией растворенного вещества существует непосредственная зависимость. Для наиболее часто применяемых кислот, растворимых оснований и солей эта зависимость
А) Приготовление 0,1н раствора серной кислоты.
1.Сколько мл 10% раствора серной кислоты (ρ, см. опыт №1) необходимо взять для приготовления 100мл 0,1н раствора серной кислоты.
2. Сколько м
Б) Приготовление раствора заданной концентрации смешением растворов более высокой и более низкой концентрации
1.Приготовить 200 мл 10%-ного раствора гидроксида натрия, имея в своем, распоряжении 30%-ный и 5%-ный растворы NaOH.
2. Приготовить 150 мл 12%-ног
Опыт 3 Определение концентрации растворов
Выполнение работыВ данной работе надлежит определить концентрацию серной кислоты в растворе, приготовленном в опыте 2а. Получить у лаборанта 0,1н. раствор щелочи, концентрац
Опыт 1. Сравнение электропроводности растворов некоторых электролитов.
Выполнение работы. Угольные электроды, укрепленные на деревянной дощечке, опустить в стакан вместимостью 50 мл и включить их в цепь последовательно с электрической лампочкой. Встав
Опыт 2. Характер диссоциации гидроксидов
Выполнение работы. Пронумеровать 5 пробирок и внести по 4-5 капель
0,5 н. растворов: в первую пробирку MgCl2 , во вторую- AlCl3 , в т
Опыт 3. Сравнение химической активности кислот
а) Взаимодействие хлороводородной и уксусной кислот с мрамором.
Выполнение работы.В одну пробирку внести 3-4 капли 2н. раствора уксу
Опыт 4. Смещение равновесия диссоциации слабых электролитов
а) Влияние соли слабых кислот на диссоциацию этой кислоты
Выполнение работы. В две пробирки по 5-7 капель 0,1 н. раствора уксусной кислоты. В каж
Опыт 1. Реакция среды в растворах различных солей
Выполнение работы.В семь пробирок налить 1,5-2 мл нейтрального раствора лакмуса. Одну пробирку оставить в качестве контрольной, а в остальные добавить по 1 микрошпателю кристаллов
А) Гидролиз сульфита натрия
Выполнение работы.Налить в пробирку до ⅓ её объёма воды, внести туда 1-2 микрошпателя кристаллов сульфита натрия и размешать стеклянной палочкой. Две капли полученного раство
A) Влияние силы кислоты и основания, образующих соль, на степень её гидролиза
Выполнение работы. В две пробирки до ⅔ их объёма налить дистиллированной воды. В одну пробирку внести один микрошпатель кристаллов сульфита натрия, в другую – столько же крис
Опыт 1 Получение водорода
Ознакомиться с устройством аппарата Киппа. Зарисовать.
Открыть кран газоотводной трубки. Наблюдать, как кислота вливается в аппарат, заполняет нижнюю часть его и поднимается в среднюю, где
ПРОВЕРКА ЧИСТОТЫ ВОДОРОДА
Держа левой рукой вертикально вверх наконечник газоотводной трубки, правой рукой одеть на него пробирку вверх дном. Выждав около минуты, медленно опускать наконечник, выводя его из пробирки. После
ПОЛУЧЕНИЕ КИСЛОРОДА И СЖИГАНИЕ В НЁМ ВЕЩЕСТВ
Опыт 1. Наполнение газометра кислородом (выполнение происходит под наблюдение преподавателя или лаборанта).
1. Ознакомиться с устройством газометра.
2. В п
Опыт 2. Сжигание серы в кислороде.
Наполнить банку кислородом из газометра. Для этого снять стёклышко, прикрывающее банку, опустить в неё наконечник газоотводной трубки газометра (следить, чтобы воронка газометра всё время была напо
Опыт 4. Сжигание железа в кислороде.
На дно банки насыпать тонкий слой сухого песка. На конце проволоки длиной 25-30 см укрепить свёрнутую в спираль струну (иглу, перо). На свободном конце её прикрепить запал: маленький кусочек лучинк
ПРОЦЕССОВ
Опыт 1. Составление медно-цинкового элемента
Выполнение работы.Один из микростаканчиков 1 (рисунок) заполнить доверх
ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ
Описанные ниже опыты проводят в приборе, представленным на рисунке.
Б) Электролиз раствора иодида калия
Выполнение работы. В коническую пробирку налить на 3/4 ее объема раствор иодида калия и добавить по 5-6 капель фенолфталеина и крахмала. Раствор переме
В) Электролиз раствора сульфата натрия
Выполнение работы. В стакане, объемом 100 мл смешать раствор сульфата натрия с нейтральным раствором лакмуса и вылить полученный раствор в электролизер. Пропустить
Опыт 1. Получение и свойства некоторых аммиакатов
Выполнение работы.Налить в коническую пробирку 10-12 капель раствора медного купороса, после чего добавлять по каплям концентрированный раствор аммиака, встряхивая каждый раз проби
Опыт 2. Исследование тетрааминкупро(׀׀) сульфата
Выполнение работы.Часть вещества растворить в пробирке в небольшом количестве воды, добавить к раствору несколько капель концентрированного раствора аммиака. Сравнить полученный ра
Опыт 1. Получение хлора
В свободном состоянии галогены получают в лаборатории из галогеноводородных кислот или их солей окислением отрицательных галид-ионов различными окислителями.
Выполнение работы.
А) Получение хлорной воды
Выполнение работы.Приготовить прибор для получения хлорной воды. В коническую пробирку налить дистиллированной воды до половины её объёма. В микроколбу положить несколько кристалло
Б) Исследование состава и свойств хлорной воды
Выполнение работы.Открыть пробирку с хлорной водой и отметить запах свободного хлора (осторожно!). При растворении в воде хлор частично реагирует с водой по уравнению:
Cl
Опыт 4. Получение иода
Выполнение работы.В сухом тигле смешать равные количества иодида калия или натрия с диоксидом марганца (по2-3 микрошпателя). К полученной смеси добавит 1-2 капли концентрированной
А) Сравнение окислительной активности свободных галогенов.
В три пробирки внести по 3-5 капель растворов: в первую - бромида калия, в две другие - иодида. Во все пробирки с растворами бромида и иодида добавить по 2-4 капли бензола. В две пробирки с раствор
Б) Действие плавиковой кислоты на стекло.
На стеклянной пластинке, покрытой слоем парафина, иглой сделать надпись или рисунок (например, формулу НF). Кисточкой смочить пластинку раствором плавиковой кислоты. Обратить внимание на то, в како
В) Получение хлороводорода и его растворение в воде.
В фарфоровую чашку или в маленький кристаллизатор налить воду, подкрашенную синим лакмусом. Приготовить прибор для получения хлороводорода и укрепить его на штативе. В микроколбу на ¼ объёма
А) Восстановление серной кислоты.
В три пробирки положить по 2-3 кристаллика: в первую – хлориды какого-либо металла, во вторую – бромида и в третью – иодида. В каждую пробирку добавить по 2-4 капли концентрированной серной кислоты
Б) Восстановление трихлорида железа.
В две пробирки внести по 3-4 капли растворов: в одну – бромида калия, в другую- иодида. В обе пробирки добавить по 3-4 капли бензола или бензина и по 1-2 капли раствора трихлорида железа. Наблюдает
Опыт 1. Получение аммиака и исследование его свойств
В фарфоровой ступке приготовить небольшое количество смеси хлорида аммония и гашеной извести (по 1/8 объёма пробирки каждого вещества) и тщательно растереть пестиком. Обратить внимание на запах. На
Опыт 2. Получение оксидов азота и азотной кислоты
Оксид азота (II) мало растворим в воде, поэтому его можно собирать над водой. Приготовить кристаллизатор или фарфоровую чашку с водой. Коническую пробирку, наполненную водой, закрыть пальцем, перев
Опыт 3. Получение азотистой кислоты и ее распад
К 4-6 каплям насыщенного раствора нитрита калия или натрия добавить 1-3 капли 2н раствора серной кислоты. Отметить появление голубой окраски азотистого ангидрида и объяснить образование бурого газа
Опыт 4. Окислительно-восстановительные свойства нитритов
Окисление нитритом иодида калия.
1.Внести в пробирку 2-4 капли раствора иодида калия и столько же 2н серной кислоты. Добавить 2-4 капли раствор
Взаимодействие разбавленной азотной кислоты с медью и оловом
В 2 пробирки внести по 3-4 капли разбавленной азотной кислоты. В одну из пробирок опустить кусочек медной стружки, в другую – кусочек олова. Отметить, что на холоде в обоих случаях реакция идёт с о
Опыт 6 . Соли азотной кислоты
1. Разложение нитрата калия.
2-3 микрошпателя сухого нитрата калия поместить в цилиндрическую пробирку. Укрепив её наклонно в штативе, нагреть до расплавления соли.
Опыт 2. Соли фосфорной ортокислоты
а) Ортофосфаты натрия и их гидролиз.
Найти константы диссоциации фосфорной ортокислоты и определить, подвергаются ли гидролизу ортофосфаты щелочных металлов. Проверить свои предположения
Опыт1. Аллотропия серы
1. Получение пластической серы. В пробирку на 10 мл. насыпать на ¼ объема мелких кусочков черенковой серы. Укрепить пробирку в держателе и нагреть равномерно пламенем горелки
Опыт 2. Получение диоксида серы и сернистой кислоты
Микро колбу наполнить на 1/3 ее объема кристаллами сульфата натрия, добавить 6-8 капель 4 и раствора серной кислоты и быстро закрыть пробкой о отводной трубкой. Заранее приготовить
Опыт 5. Дегидратирующие свойства серной кислоты
Взаимодействие с клетчаткой. Опустить конец стеклянной палочки в раствор разбавленной серной кислоты (1:1) и провести ее по листу фильтровальной бумаги. Подсушить слегка бумагу над пламенем г
Опыт 6 Теосерная кислота и теосульфаты
1. Исследование тиосерной кислоты. Внести в пробирку 5-6 капель раствора тиосульфата натрия Na2S2O3 и 3-4 капли раствора серной кислоты. Отметить выпадение серы. И по запаху определ
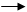 P+CuSO4+H2O H3PO4+H2SO4+Cu
P+CuSO4+H2O H3PO4+H2SO4+Cu






Новости и инфо для студентов