рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Закономерность изучается на примере взаимодействия тиосульфата натрия с серной кислотой
Реферат Курсовая Конспект
Закономерность изучается на примере взаимодействия тиосульфата натрия с серной кислотой
Закономерность изучается на примере взаимодействия тиосульфата натрия с серной кислотой - раздел Химия, Тема : Скорость Химических Реакций И ...
Тема : СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Зависимость скорости реакции от температуры
( проверка правила Вант-Гоффа)
Закономерность изучается на примере взаимодействия тиосульфата натрия с серной кислотой
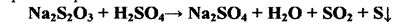
Реакция протекает в две стадии:
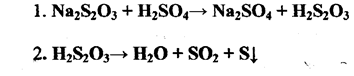
Первая стадия - ионный обмен - происходит мгновенно, так что фактически наблюдение ведётся за скоростью второй мономолекулярной стадии, признаком протекания которой является появления мути как результат образования элементарной серы. Поэтому концентрации серной кислоты фактически не сказывается на скорости реакции, лишь бы она была взята в количестве, достаточном для полного взаимодействия тиосульфата, и во всех опытах одинакова.
Следовательно, уравнение скорости может быть записано так:
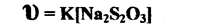
Опыт 1. Приготовить простейший термостат: стакан на 200 мл с крышкой, в которой имеются 3 отверстия. В первое отверстие опустить закрепленный на нитке термометр, во второе - коническую пробирку с —2н раствором Н2SO4 с опущенной в неё пипеткой, в третье - коническую пробирку, в которую чистой пипеткой внести 10 капель 0,1-н раствора тиосульфата натрия. Стакан заполнить выдержанной при комнатной температуре водой настолько, чтобы шарик термометра и раствора были в неё погружены. Ртутный шарик термометра и растворы реагирующих веществ должны находиться на одном уровне в средней части воды, заполняющей стакан - термостат.
Выждав 5 минут – время, необходимое для выравнивания температуры воды в термостате и растворов в пробирках, записать показания термометра. Не вынимая пробирки из термостата, к раствору тиосульфата натрия добавить пипеткой 1 каплю раствора серной кислоты. В этот момент включить секундомер ( замерить время по часам с секундной стрелкой ), не вынимая пробирку из термостата, наблюдать за ходом опыта до появления в пробирке заметного на глаз помутнения и при обнаружении его выключить секундомер. Записать длительность опыта в секундах.
Опыт 2. Проводится при температуре, повышенной на 10°. Для этого пробирку в термостате, в которой проводился опыт, заменить чистой и вновь внести в неё 10 капель 0,1н раствора тиосульфата натрия. Добавляя в стакан горячую воду, поднять её температуру на 14 - 15° выше температуры первого опыта и по термометру наблюдать её охлаждение. Когда температура будет на 10° выше, провести опыт точно так же, как первый.
Опыт 3. Проведение опыта при температуре, повышенной на 20°.Опыт проводиться так же, как в предыдущем случае, но температура воды в термостате первоначально повышается на 24 - 25°выше комнатной, а добавление серной кислоты к гипосульфиту производится в тот момент, когда она будет выше температуры первого опыта ровно на 20°. Все опытные данные и результаты расчетов записываются в виде таблицы. Вместо индексов указать фактические температуры.

Вычислить:
А) относительную скорость реакции.
Примем скорость реакции при комнатной температуре
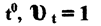
в первом опыте. Поскольку скорость и величина, обратная времени,
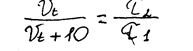
из этой пропорции находим
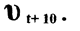
Аналогично составляем пропорцию и вычисляем
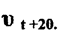
Б) термический коэффициент скорости по Вант - Гоффу. Его вычисляют по результатам двух опытов, независимо один от другого.
Выполнение работы является удовлетворительным в том случае, если результаты этих двух вычислений расходятся незначительно. Тогда можно взять их средние значения. При резком расхождении работу нужно повторить.
Скорость химических реакций в гомогенных и
ГЕТЕРОГЕННЫХ СИСТЕМАХ
Опыт 1. Влияние величины поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе
Растворение карбоната кальция в хлороводородной кислоте
Выполнение работы. Взять два небольших, по возможности одинаковых, кусочка мела. Один из них положить на кусочек фильтровальной бумаги и стеклянной палочкой измельчить его в порошок. Полученный порошок поместить в коническую пробирку. Второй кусочек мела целиком опустить в другую коническую пробирку. В обе пробирки одновременно добавить одинаковое количество (10—20 капель) хлороводородной кислоты плотностью - 1,19 г/см3. (Для соблюдения одновременности добавления кислоты опыт могут проводить два студента совместно). Отметить время полного растворения мела в каждом случае.
Запись данных опыта. Написать уравнение соответствующей
реакции. Почему скорость растворения мела в этих двух случаях
различна?
Опыт 2. Влияние катализатора на скорость реакции
Каталитическое восстановление железа (III) Выполнение работы. В две пробирки внести по 10 капель 0,5 н. раствора роданида калия и по 1 капле 0,5 н. раствора…Опыт 3. Смещение химического равновесия обратимых реакций
Влияние концентрации реагирующих веществ на смещение равновесия Выполнение работы. В четыре конические пробирки внести по 5—7 капель 0,0025 н. растворов хлорида железа (III) и…ТЕМА : РАСТВОРЫ
Опыт 1 Определение плотности раствора ареометром.
Рисунок 1- Ареометр для определения плотности раствораОпыт 2 Приготовление растворов различной концентрации
А) Приготовление 0,1н раствора серной кислоты.
2. Сколько мл 10% раствора серной кислоты (ρ, см. опыт №1) необходимо взять для приготовления 250мл 0,1н раствора серной кислоты. 3. Сколько мл 15% раствора серной кислоты (ρ, см. опыт №1) необходимо… 4. Сколько мл 15% раствора серной кислоты (ρ, см. опыт №1) необходимо взять для приготовления 250мл 0,1н раствора…Б) Приготовление раствора заданной концентрации смешением растворов более высокой и более низкой концентрации
2. Приготовить 150 мл 12%-ного раствора гидроксида натрия, имея в своем, распоряжении 5%-ный и 25%-ный растворы NaOH. 3. Приготовить 500 мл 20%-ного раствора гидроксида натрия, имея в своем,… 4. Приготовить 250 мл 15%-ного раствора гидроксида натрия, имея в своем, распоряжении 8%-ный и 25%-ный растворы…Опыт 3 Определение концентрации растворов
Бюретку вместимостью 10 мл (рисунок 2в) промыть небольшим объемом 0,1н раствора NaOH, после чего вылить ее через нижний конец бюретки, снабженный… В коническую колбочку вместимостью 30-50 мл сухой пипеткой (рисунок 2б) внести… Повторить титрование еще три раза. Резкое изменение окраски фенолфталеина от одной капли щелочи является показателем…ТЕМА: ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Опыт 1. Сравнение электропроводности растворов некоторых электролитов.
В стакан с электродами налить 20-30 мл дистиллированной воды. Загорается ли лампочка? Проводит ли вода электрически ток? Внести в стакан с водой 4-5… Объяснить, почему раствор соли является проводником тока, хотя чистая вода и… В четыре стакана вместимостью 50 мл каждый налить по 20-30 мл 0,1 н. растворов: в первый – хлороводородной кислоты, во…Опыт 2. Характер диссоциации гидроксидов
Выполнение работы. Пронумеровать 5 пробирок и внести по 4-5 капель 0,5 н. растворов: в первую пробирку MgCl2 , во вторую- AlCl3 , в третью… Аналогичным образом исследовать свойства гидроксидов алюминия, кремния, никеля(II) и цинка. В чем они растворяются?…Опыт 3. Сравнение химической активности кислот
а) Взаимодействие хлороводородной и уксусной кислот с мрамором. Выполнение работы.В одну пробирку внести 3-4 капли 2н. раствора уксусной кислоты, в другую – столько же 2 н. раствора…Опыт 4. Смещение равновесия диссоциации слабых электролитов
а) Влияние соли слабых кислот на диссоциацию этой кислоты Выполнение работы. В две пробирки по 5-7 капель 0,1 н. раствора уксусной кислоты. В каждую пробирку прибавить одну…Опыт 1. Реакция среды в растворах различных солей
Растворы размешать (стеклянные палочки не переносить из одного раствора в другой). По изменению окраски лакмуса сделать вывод о реакции среды в растворе каждой… Какие из исследованных солей подвергаются гидролизу? Написать ионные и молекулярные уравнения реакций их гидролиза и…Опыт 2. Образование основных и кислых солей при гидролизе
А) Гидролиз сульфита натрия
На присутствие каких ионов в растворе указывает найденное значение pH? В результате какого процесса эти ионы появились? По отсутствию запаха сернистого газа убедиться в том, что сульфит натрия… Написать молекулярное и ионное уравнения реакции гидролиза сульфита натрия. При гидролизе каких солей получаются…Опыт 3. Факторы, влияющие на степень гидролиза солей
A) Влияние силы кислоты и основания, образующих соль, на степень её гидролиза
Написать ионные уравнения гидролиза сульфита натрия и карбоната натрия (по первой ступени). В растворе какой соли окраска фенолфталеина более… Степень гидролиза какой соли при одинаковых концентрациях и температуре должна… Сделать общий вывод о влиянии силы кислоты и основания, образующих соль, на степень её гидролиза.ТЕМА: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
ПРОЦЕССЫ
ВОДОРОД
Опыт 1 Получение водорода
Открыть кран газоотводной трубки. Наблюдать, как кислота вливается в аппарат, заполняет нижнюю часть его и поднимается в среднюю, где находится… Ознакомиться с автоматичностью действия аппарата Киппа. Для этого закрыть кран… НИКОГДАне зажигать водород на конце газоотводной трубки аппарата Киппа, не проверив его на чистоту и не будучи…ПРОВЕРКА ЧИСТОТЫ ВОДОРОДА
Опыт 2 Переливание водорода.
Проверить чистоту водорода и наполнить им большую пробирку, держа её вверх дном, поместить с ней рядом, тоже вверх дном, другую пробирку так, чтобы их отверстия были рядом. Не отодвигая пробирки с водородом, повёртывать её вниз дном так, чтобы пустая пробирка накрыла бы пробирку с водородом. Разъединив пробирки, поднести каждую из них к пламени спиртовки. В какой пробирке наблюдается вспышка?
Опыт 3 Образование воды при горении.
ПРОВЕРИТЬ ВОДОРОД на чистоту. Если он чист, зажгите его на конце газоотводной трубки и, держа трубку вверх, накройте пламя стеклянной банкой, прекратив процесс выделения водорода. Что для этого надо сделать? Что наблюдается на стенках банки? Записать уравнение реакции.
КИСЛОРОД
ПОЛУЧЕНИЕ КИСЛОРОДА И СЖИГАНИЕ В НЁМ ВЕЩЕСТВ
1. Ознакомиться с устройством газометра. 2. В пробирку поместить перманганат калия, закрыть пробкой с газоотводной…Опыт 2. Сжигание серы в кислороде.
Опыт 3. Сжигание магния в кислороде.
Наполнить банку кислородом, как в предыдущем опыте. Взять тигельными щипцами стружку или ленту магния, нагревать в пламени спиртовки, пока она не загорится и быстро внести в банку с кислородом. Что собой представляет оксид магния? Испытать характер оксида магния. Для этого, как в предыдущем опыте, влить в банку немного раствора фиолетового лакмуса и взболтать. Как изменился цвет лакмуса? Сделать вывод о характере образующегося гидроксида.
Опыт 4. Сжигание железа в кислороде.
Влияние среды на протекание окислительно - восстановительных процессов Влияние рН среды на характер восстановления перманганата калияH2O2 + 2H+ + 2e- = 2H2O
для реакции окисления пероксида водорода (H2O2 – восстановитель):
H2O2 – 2e- = O2 + 2H+
б)Взаимодействие пероксида водорода с иодидом калия
Выполнение работы.К раствору иодида калия, подкисленному серной кислотой, прибавить 1 – 2 капли раствора пероксида водорода. Для какого вещества характера появившаяся окраска раствора?
Написать уравнение реакции. Окислителем или восстановителем является в ней пероксид водорода?
в ) Взаимодействие пероксида водорода с оксидом ртути (II)
Выполнение работы.Поместить в пробирку 3 – 4 капели раствора нитрата ртути Hg(NO3)2 и добавить столько же 2 н. раствора щелочи до выпадения осадка оксида ртути (II). Отметить цвет осадка. Добавить 4 – 5 капель раствора пероксида водорода и наблюдать изменение цвета осадка вследствие образования взвешенных частиц металлической ртути. Какой газ выделяется?
Написать уравнение реакции. Окислитлем и восстановителем является пероксид водорода в данной реакции? Сделать соотвествующие выводы.
ОПРЕДЕЛЕНИЕ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ. НАПРАВЛЕНИЕ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ
ПРОЦЕССОВ
Выполнение работы.Один из микростаканчиков 1 (рисунок) заполнить доверху 1М раствором сульфата цинка (точнее раствором, в котором активность ионов… Запись данных опыта.Изобразить двойной электрический слой на границе раздела металл — раствор его соли на цинковом и…ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ
Описанные ниже опыты проводят в приборе, представленным на рисунке.Б) Электролиз раствора иодида калия
Отметить изменение цвета раствора около катода и анода. Написать уравнение катодного и анодного процессов. Почему окрасились растворы в катодном и…В) Электролиз раствора сульфата натрия
Выполнение работы. В стакане, объемом 100 мл смешать раствор сульфата натрия с нейтральным раствором лакмуса и вылить полученный раствор в…Г) Электролиз водных растворов солей с растворимыми анодами
Выполнение работы. Налить в электролизер 0,5 н. раствор сульфата меди, опустить в него графитовые электроды и пропустить через раствор электрический ток. Через несколько минут прекратить электролиз и отметить на катоде красный налет меди. Написать уравнения катодного и анодного процессов. Какой газ в небольших количествах выделяется на аноде?
Не отключая электролизер от батарейки, поменять местами электроды в коленах электролизера, вследствие чего электрод, покрывшийся вначале медью, окажется анодом. Снова пропустить электрический ток. Что происходит с медью на аноде? Какое вещество выделяется на катоде? Написать уравнения катодного и анодного процессов, протекающих при электролизе сульфата меди с медным анодом.
Провести аналогичный опыт с 0,5 н. раствором сульфата никеля (II). Что выделяется на катоде? Написать уравнение катодного восстановления никеля. Какое вещество окисляется на аноде при электролизе сульфата никеля с угольным анодом? С никелевым анодом? Написать уравнения соответствующих анодных процессов.
ТЕМА: КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Опыт 1. Получение и свойства некоторых аммиакатов
Разбавить раствор приблизительно равным объёмом спирта и отцентрифуговать образовавшиеся при этом кристаллы [Сu(NH3)4]SO4 ·H2O – комплексного… Написать уравнения всех реакций, проведённых в этом опыте.Опыт 2. Исследование тетрааминкупро(׀׀) сульфата
В четыре пронумерованные пробирки внести пипеткой по 10 капель исследуемого раствора комплексной соли. а) Проба на ион Cu2+ действием щёлочи. В пробирку №1 добавить несколько капель… б) Проба на ион Cu2+ действием сульфида натрия. В пробирку №2 добавить несколько капель раствора Na2S. Наблюдается ли…ТЕМА: ХИМИЯ ЭЛЕМЕНТОВ
ГАЛОГЕНЫ
Опыт 1. Получение хлора
Выполнение работы. В три пробирки положить по 3-4 кристаллика различных окислителей: в первую диоксида марганца MnO2 или диоксида свинца PbO2, во… а) получение хлора, учитывая, что окислительные числа марганца меняются с +4 в… б) взаимодействия хлора с тиосульфатом натрия с участием воды; реакция протекает с образованием свободной серы,…Опыт 2. Получение хлорной воды и исследование её свойств
А) Получение хлорной воды
Написать уравнение реакции получения хлора окислением соляной кислоты перманганатом калия, учитывая, что окислительное число марганца изменяется от…Б) Исследование состава и свойств хлорной воды
Cl2 + H2O ↔HClO + HCl. (1) При этом равновесие сильно смещено влево. Поэтому хлорной водой можно… HClO = HCl + O (2)Опыт 3. Получение брома
Выполнение работы.В сухую цилиндрическую пробирку поместить 2-3 кристаллика бромида калия или натрия и столько же диоксида марганца. Осторожно встряхнуть пробирку и прибавить к смеси 2-3 капли концентрированной серной кислоты (пл. 1,84 г/см3). Что представляют собой выделяющиеся бурые пары? Написать уравнение реакции получения брома.
Опыт 4. Получение иода
Опыт 5. Окислительные свойства свободных галогенов (окислительное число равно…А) Сравнение окислительной активности свободных галогенов.
По окраске бензольного кольца определить, какой галоген выделяется в свободном состоянии в каждом случае. Написать уравнения реакций взаимного…Б) Окисление бромом магния или цинка.
Внести впробирку 3 – 5 капель бромной воды и немного порошка магния или цинка. Перемешать стеклянной палочкой. Отметить обесцвечивание растворов бромной водой и указать причину этого явления. Написать соответствующее уравнение реакции.
Опыт 6. Получение водородных соединений галогенов (галогеноводородов).
Галогеноводороды могут быть получены действием нелетучих и не являющихся окислителями кислот на галиды металлов.
Б) Действие плавиковой кислоты на стекло.
В) Получение хлороводорода и его растворение в воде.
Наполнив пробирку сероводородом, плотно закрыть ее пробкой. Отсоединить капилляр от трубки, быстро закрыть его указательным пальцем и, перевернув…Г) Получение бромоводорода и иодоводорода.
Положить в одну пробирку 2-3 микрошпателя бромида кадия или натрия, в другую – столько же какого-либо иодида. В обе пробирки добавить по 5-10 капель концентрированного раствора фосфорной ортокислоты. Подогреть растворы на маленьком пламени горелки. Наблюдать выделение бромоводорода и иодоводорода в виде белого дыма. Выделяется ли при этом свободный бром и иод? Сделать вывод, окисляет ли фосфорная кислота бромоводород и иодоводород? Написать уравнения реакций.
Опыт 7. Восстановительные свойства галогеноводородов и галид- ионов.
А) Восстановление серной кислоты.
Отметить во второй пробирке выделение бурых паров брома и диоксида серы SO2, в третьей – фиолетовых паров иода, серы и сероводорода, образующихся… Написать уравнение реакции взаимодействия хлорида, бромида и иодида калия или…Б) Восстановление трихлорида железа.
Могут ли отрицательные ионы галогенов являться окислителями? Ответ обосновать. Опыт 8. Взаимодействие брома с алюминием. В демонстрационную пробирку, закрепленную в штативе над поддоном с песком, налить бром. Опустить в него алюминиевый…Опыт 1. Получение аммиака и исследование его свойств
Опыт 2. Получение оксидов азота и азотной кислоты
а) получения оксида азота (II) взаимодействием разбавленной азотной кислоты с медью; б) окисления оксида азота (II) до оксида азота (IV) и полимеризации оксида… в) взаимодействия диоксида азота с водой, протекающего с образованием азотной и азотистой кислот;Опыт 3. Получение азотистой кислоты и ее распад
а) взаимодействие нитрита калия с серной кислотой; б) разложения азотистой кислоты; в) распад азотистого ангидрида.Опыт 4. Окислительно-восстановительные свойства нитритов
1.Внести в пробирку 2-4 капли раствора иодида калия и столько же 2н серной кислоты. Добавить 2-4 капли раствора нитрита калия или натрия. Чем… 2. Взаимодействие нитрита калия с перманганатом. В пробирку внести 2-3 капли…Опыт 5. Окислительные свойства азотной кислоты
Взаимодействие разбавленной азотной кислоты с медью и оловом
2. Взаимодействие концентрированной азотной кислотой с медью и оловом. В 2 пробирки поместить по маленькому кусочку меди и олова. Прибавить к ним по…Опыт 6 . Соли азотной кислоты
2-3 микрошпателя сухого нитрата калия поместить в цилиндрическую пробирку. Укрепив её наклонно в штативе, нагреть до расплавления соли. Внести…Опыт 1. Аллотропия фосфора
P+CuSO4+H2O H3PO4+H2SO4+CuОпыт 2. Соли фосфорной ортокислоты
Найти константы диссоциации фосфорной ортокислоты и определить, подвергаются ли гидролизу ортофосфаты щелочных металлов. Проверить свои…СЕРА И ЕЕ СВОЙСТВА
Опыт1. Аллотропия серы
1. Получение пластической серы. В пробирку на 10 мл. насыпать на ¼ объема мелких кусочков черенковой серы. Укрепить пробирку в держателе и…Опыт 2. Получение диоксида серы и сернистой кислоты
Микро колбу наполнить на 1/3 ее объема кристаллами сульфата натрия, добавить 6-8 капель 4 и раствора серной кислоты и быстро закрыть пробкой о… Опыт 3. Окислительные и восстановительные свойства серы(IV)Опыт 5. Дегидратирующие свойства серной кислоты
Опыт 6 Теосерная кислота и теосульфаты
1. Исследование тиосерной кислоты. Внести в пробирку 5-6 капель раствора тиосульфата натрия Na2S2O3 и 3-4 капли раствора серной кислоты. Отметить… 2. Взаимодействие тиосульфата натрия с хлором и бромом. В две пробирки с… 3. Взаимодействие тиосульфата натрия с йодом. В пробирку с йодной водой (5-6 капель) прибавить по каплям раствор…ПРИЛОЖЕНИЕ
Таблица 1 - Константы нестойкости некоторых комплексных ионов
| Комплексный ион | Кнест |
| [Ag(CN)2]- | 1 ∙ 10 -21 |
| [Ag(NH3) 2]+ | 7 ∙ 10 -8 |
| [Ag(S2O3) 2]3- | 1 ∙ 10 -13 |
| [CdCl4]2- | 9 ∙ 10 -3 |
| [CdI4] 2- | 8 ∙ 10 -7 |
| [Cd(CN) 4] 2- | 1 ∙ 10 -17 |
| [Cd(NH3) 4] 2+ | 8 ∙ 10 -8 |
| [Cd(NH3) 6] 2+ | 8 ∙ 10 -6 |
| [Co(NH3) 6] 3+ | 6 ∙ 10 -36 |
| [Cu(NH3) 4] 2+ | 2 ∙ 10 -13 |
| [Cu(CN) 4] 3- | 5 ∙ 10 -28 |
| [Fe(CN) 6] 4- | 1 ∙ 10 -37 |
| [Fe(CN) 6] 3- | 1 ∙ 10 -44 |
| [Fe(SCN) ] 2+ | 1 ∙ 10 -3 |
| [HgBr4] 2- | 1 ∙ 10 -21 |
| [HgCl4] 2- | 8 ∙ 10 -16 |
| [HgI4] 2- | 1 ∙ 10 -30 |
| [Hg(SCN)4] 2- | 1 ∙ 10 -22 |
| [Ni(CN) 4] 2- | 3 ∙ 10 -16 |
| [Ni(NH3) 6 ] 2+ | 2 ∙ 10 -9 |
| [Zn(CN) 4] 2- | 2 ∙ 10 -17 |
| [Zn(NH3) 4]] 2+ | 4 ∙ 10 -10 |
Таблица 2 - Плотность растворов некоторых кислот, щелочей и аммиака при 200С (в г/см3, г/мл).
| Концен-трация,% | H2SO4 | HNO3 | HCl | KOH | NaOH | HN3 |
| 1.013 | 1.011 | 1.009 | 1.016 | 1.023 | 0.992 | |
| 1.027 | 1.022 | 1.019 | 1.033 | 1.046 | 0.983 | |
| 1.040 | 1.033 | 1.029 | 1.048 | 1.069 | 0.973 | |
| 1.055 | 1.044 | 1.039 | 1.065 | 1.092 | 0.967 | |
| 1.069 | 1.056 | 1.049 | 1.082 | 1.115 | 0.960 | |
| 1.083 | 1.068 | 1.059 | 1.100 | 1.137 | 0.953 | |
| 1.098 | 1.080 | 1.069 | 1.118 | 1.159 | 0.946 | |
| 1.112 | 1.093 | 1.079 | 1.137 | 1.181 | 0.939 | |
| 1.127 | 1.106 | 1.083 | 1.156 | 1.213 | 0.932 | |
| 1.143 | 1.119 | 1.100 | 1.176 | 1.225 | 0.926 | |
| 1.158 | 1.132 | 1.110 | 1.196 | 1.247 | 0.919 | |
| 1.174 | 1.145 | 1.121 | 1.217 | 1.268 | 0.913 | |
| 1.190 | 1.158 | 1.132 | 1.240 | 1.289 | 0.908 | |
| 1.205 | 1.171 | 1.142 | 1.263 | 1.310 | 0.903 | |
| 1.224 | 1.184 | 1.152 | 1.286 | 1.332 | 0.898 | |
| 1.238 | 1.198 | 1.163 | 1.310 | 1.352 | 0.893 | |
| 1.255 | 1.211 | 1.173 | 1.334 | 1.374 | 0.889 | |
| 1.273 | 1.225 | 1.183 | 1.358 | 1.395 | 0.884 | |
| 1.290 | 1.238 | 1.194 | 1.384 | 1.416 | ||
| 1.307 | 1.251 | 1.411 | 1.437 | |||
| 1.324 | 1.264 | 1.437 | 1.458 | |||
| 1.342 | 1.277 | 1.460 | 1.478 | |||
| 1.361 | 1.290 | 1.485 | 1.499 | |||
| 1.380 | 1.303 | 1.511 | 1.519 | |||
| 1.399 | 1.316 | 1.538 | 1.540 | |||
| 1.419 | 1.328 | 1.564 | 1.560 | |||
| 1.439 | 1.340 | 1.590 | 1.580 | |||
| 1.460 | 1.351 | 1.616 | 1.601 | |||
| 1.482 | 1.362 | 1.622 | ||||
| 1.503 | 1.373 | 1.643 | ||||
| 1.525 | 1.384 | |||||
| 1.547 | 1.394 | |||||
| 1.571 | 1.403 | |||||
| 1.594 | 1.412 | |||||
| 1.617 | 1.421 | |||||
| 1.640 | 1.429 | |||||
| 1.664 | 1.437 | |||||
| 1.687 | 1.445 | |||||
| 1.710 | 1.453 | |||||
| 1.732 | 1.460 | |||||
| 1.755 | 1.467 | |||||
| 1.776 | 1.474 | |||||
| 1.808 | 1.486 | |||||
| 1.819 | 1.491 | |||||
| 1.830 | 1.496 | |||||
| 1.837 | 1.500 | |||||
| 1.841 | 1.510 | |||||
| 1.838 | 1.522 |


– Конец работы –
Используемые теги: закономерность, изучается, мере, взаимодействия, тиосульфата, натрия, серной, кислотой0.094
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Закономерность изучается на примере взаимодействия тиосульфата натрия с серной кислотой
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов