рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Составление уравнений окислительно-восстановительных реакций
Реферат Курсовая Конспект
Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций - раздел Химия, Свойства элементарных частиц, образующих атом A Электронный Баланс - Метод Нахожден...
A Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
1. Записывают схему реакции.
KMnO4 + HCl ® KCl + MnCl2 + Cl2 + H2O
2. Проставляют степени окисления над знаками элементов, которые меняются.
KMn+7O4 + HCl-1 ® KCl + Mn+2Cl2 + Cl20 + H2O
3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем.
Mn+7 + 5ē ® Mn+2
2Cl-1 - 2ē ® Cl20
4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
| Mn+7 + 5ē ® Mn+2 | |
| 2Cl-1 - 2ē ® Cl20 |
––––––––––––––––––––––––
2Mn+7 + 10Cl-1 ® 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех остальных участников реакции.
2KMn+7O4 + 16HCl-1 ® 2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O
B Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в которомрассматривается обмен электронами между ионами в растворе с учетом характера среды:
| 2Cl1- – 2ē ® | Cl20 | ||
| MnO41- + 8H+ | + 5ē ® | Mn2+ + 4H2O | |
| 7+ | 2+ |
––––––––––––––––––––––––––––––––––––––
10Cl- + 2MnO41- + 16H+ ® 5Cl20 + 2Mn2+ + 8H2O
(для уравнивания ионной полуреакции используют H+, OH- или воду)
СУЩНОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
Окислительно-восстановительные процессы принадлежат к числу более распространенных хим реакций и имеют большущее значение в теории и практике. Окисление-восстановление—один из важных действий природы.
Дыхание, усвоение углекислого газа растениями с выделением кислорода, обмен веществ и ряд остальных хим действий в базе собственной являются окислительно-восстановительными реакциями. Сжигание топлива в топках паровых котлов и движках внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумах, включают реакции окисления-восстановления.
Получение элементарных веществ (железа, хрома, марганца, золота, серебра, серы, хлора, йода и т.д.) и ценных хим товаров (аммиака, щёлочей, азотной, серной и остальных кислот) базирована на окислительно-восстановительных реакциях.
На окислении-восстановлении в аналитической химии основаны способы объёмного анализа: перманганатометрия, йодометрия, броматометрия, и остальные, играющие важную роль при контролировании производственных действий и выполнении научных исследований. В органической химии для проведения ряда хим перевоплощений самое обширное распространение отыскали процессы окисления-восстановления.
Инертные газы только в исключительных вариантах способны вступать в окислительно-восстановительные реакции.
54. Активные окислители
Чем больше абс. величина 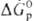 или
или 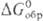 , тем более активным окислителем является данное в-во. Так, при обычных условиях в р-циях Са + Х2
, тем более активным окислителем является данное в-во. Так, при обычных условиях в р-циях Са + Х2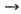 СаХ2 (где X = Cl, F), Са + 1/2O2,
СаХ2 (где X = Cl, F), Са + 1/2O2, 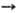 CaO хлор-более активный окислитель, чем О, но менее активный, чем F2 (
CaO хлор-более активный окислитель, чем О, но менее активный, чем F2 (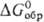 CaO -603,9, СаСl2 -749,3, CaF2 -1168,4 кДж/моль).
CaO -603,9, СаСl2 -749,3, CaF2 -1168,4 кДж/моль).
Активные восстановители
Чем больше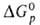 или абс. величина
или абс. величина , тем более активным восстановителем является данное в-во. так, при обычных условиях в р-циях nМ + mМ'Fn -> nMFm + mM'кальций - более активный восстановитель фторидов металлов (
, тем более активным восстановителем является данное в-во. так, при обычных условиях в р-циях nМ + mМ'Fn -> nMFm + mM'кальций - более активный восстановитель фторидов металлов (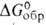 CaF2, отнесенная к одному атому фтора, - 584,2 кДж/моль), чем Mg (-535,5 кДж/моль) и А1 (-477,1 кДж/моль), но менее активный, чем Li (для LiF
CaF2, отнесенная к одному атому фтора, - 584,2 кДж/моль), чем Mg (-535,5 кДж/моль) и А1 (-477,1 кДж/моль), но менее активный, чем Li (для LiF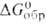 — 588,0 кДж/моль).
— 588,0 кДж/моль).
Влияние среды на характер протекания реакции:
– Конец работы –
Эта тема принадлежит разделу:
Свойства элементарных частиц, образующих атом
Химический элемент совокупность атомов с одинаковым зарядом ядра и числом протонов совпадающим с порядковым атомным номером в таблице... Основные Понятия химии Закон сохранения массы исторический закон физики... Эквиваленты простых и сложных веществ Эквивалент это реальная или условная частица вещества которая в...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Составление уравнений окислительно-восстановительных реакций
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов