Типы поляризации
- Электронная — смещение электронных оболочек атомов под действием внешнего электрического поля. Самая быстрая поляризация (до 10−15 с). Не связана с потерями.
- Ионная — смещение узлов кристаллической структуры под действием внешнего электрического поля, причем смещение на величину, меньшую, чем величина постоянной решетки. Время протекания 10−13 с, без потерь.
- Дипольная (Ориентационная) — протекает с потерями на преодоление сил связи и внутреннего трения. Связана с ориентацией диполей во внешнем электрическом поле.
- Электронно-релаксационная — ориентация дефектных электронов во внешнем электрическом поле.
- Ионно-релаксационная — смещение ионов, слабо закрепленных в узлах кристаллической структуры, либо находящихся в междуузлие.
- Структурная — ориентация примесей и неоднородных макроскопических включений в диэлектрике. Самый медленный тип.
- Самопроизвольная (спонтанная) — благодаря наличию этого типа поляризации в диэлектрике проявляются нелинейность свойств, то есть явление гистерезиса. Отличается очень высокими значениями диэлектрической проницаемости (от 900 до 7500 у некоторых видов конденсаторной керамики). Введение спонтанной поляризации, как правило, увеличивает тангенс угла потерь материала (до 10−2)
- Резонансная — ориентация частиц, собственные частоты которых совпадают с частотами внешнего электрического поля.
- Миграционная поляризация обусловлена наличием в материале слоев с различной проводимостью, образованию объемных зарядов, особенно при высоких градиентах напряжения, имеет большие потери и является поляризацией замедленного действия.
15) Электролиз – это окислительно-восстановительный процесс, происходящий на электродах при пропускании электрического тока через расплав или раствор электролита.
Электролиз расплава хлорида натрия:
NaCl 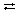 Na+ + Cl–;
Na+ + Cl–;
катод (–) (Na+): Na+ + е = Na0,
анод (–) (Cl–): Cl– – е = Cl0, 2Cl0 = Cl2;
(2H2O + 2е = H2 + 2OH–),
анод (+) (Cl–; OН–): Cl– – е = Cl0, 2Cl0 = Cl2;
2NaCl + 2H2O = 2NaOH + Cl2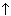 + H2
+ H2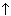
2NaCl = 2Na + Cl2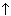 .
.
Электролиз раствора хлорида натрия:
NaCl 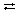 Na+ + Cl–,
Na+ + Cl–,
H2O 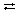 Н+ + ОН–;
Н+ + ОН–;
катод (–) (Na+; Н+): H+ + е = H0, 2H0 = H2
16) Это масса вещества, образовавшегося в результате электролиза при пропускании через раствор тока определенной силы (I - сила тока, измеряется в амперах - А) в течение определенного времени (t, измеряется в секундах - с). Рассчитывается с помощью закона Фарадея по формуле:
m = (э*I*t)/F, где э - эквивалентная масса вещества, равная отношению его молярной массы к количеству принятых (или отданных) электронов; F = 96 500 Кл - число Фарадея
(т.е. расчет не по другим веществам - участникам реакции (реагентам или продуктам), а по значениям силы тока и времени электролиза).
Практический выход по току обычно меньше 100% (если в долях единицы - меньше 1), т.к. на практике, в реальных условиях, обязательно будут потери вещества. В таком случае выход по току равен отношению практической массы продукта электролиза к теоретической, рассчитанной по закону Фарадея; для выражения выхода в процентах результат нужно умножить на 100%. Выход продукта реакции обозначается греческой буквой "эта".
17) Гальваническое покрытие представляет из себя металлическую плёнку, которая наносится на поверхность металлических и других изделий в защитных, декоративных и других целях методом гальваностегии. Нанесение гальванического покрытия повышает износоустойчивость изделия, с его помощью может быть практически устранена или уменьшена коррозия металлов. Существует несколько видов гальванического покрытия – это хромирование, никелирование, цинкование, покрытие олово-цинком и другие.
18) масса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
асса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
М=k*q=k*i*t
М – это масса вещества;
Q – это электрический заряд;
I – это сила тока;
t - время.
k – это коэффициент пропорциональности, который в данном случае называют электрохимическим эквивалентом вещества. Коэффицуиент пропорциональности равняется массе вещества, которое образуется в результате прохождения через электролит электрического заряда. k зависит от химических свойств вещества.
Второй закон электролиза Фарадея