Строение молекул
Физические и химические свойства молекул определяются их строением.Поэтому многие свойства могут быть предсказаны на основании структурной формулы. К таким свойствам относятся размеры, форма, до некоторой степени конформациямолекул (т.е. взаимное расположение отдельных атомов) при нахождении вещества в растворе и, наконец, реакционная способность. В этом разделе сведены параметры, на основании которых можно прогнозировать свойства соединений. З
Молекулы, которые образованы атомами одного и того же элемента, как правило, будут неполярными, как неполярны и сами связи в них. Так, молекулы Н2, F2, N2 неполярны.
Молекулы, которые образованы атомами разных элементов, могут быть полярными и неполярными. Это зависит от геометрической формы.
олярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный момент μ, равный произведению элементарного заряда на длину диполя *) μ = e ∙ l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
Дипольный момент химической связи обусловлен смещением электронного облака в сторону одного из атомов. Связь называют полярной, если соответствующий дипольный момент существенно отличается от нуля. Возможны случаи, когда отдельные связи в молекуле полярны. а суммарный дипольный момент молекулы равен нулю; такие молекулы наз. неполярными (напр., молекулы СО2 и CCl4). Если же дипольный момент молекулы отличен от нуля, молекула наз. полярной. Напр., молекула Н2О полярна; суммирование дипольных моментов двух полярных связей ОН также дает отличный от нуля дипольный момент, направленный по биссектрисе валентного угла НОН.
Порядок величины дипольный момент молекулы определяется произведением заряда электрона (1,6.10-19 Кл) на длину химической связи (порядка 10-10 м), т. е. составляет 10-29 Кл.м. В справочной литературе дипольный момент молекул приводят в дебаях (Д или D), по имени П. Дебая; 1 Д = 3,33564.10-30 Кл.м.
Дипольный момент электрический, векторная величина, характеризующая асимметрию распределения положительных и отрицательных зарядов в электрически нейтральной системе. Два одинаковых по величине заряда +q и —q образуют электрический диполь с дипольный момент m = q l, где l - расстояние между зарядами. Для системы из n зарядов qi радиусы-векторы которых ri, 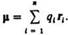 В молекулах и молекулярных системах центры положительных зарядов qА совпадают с положениями атомных ядер (радиусы-векторы rA), а электронное распределение описывается плотностью вероятности r(r).
В молекулах и молекулярных системах центры положительных зарядов qА совпадают с положениями атомных ядер (радиусы-векторы rA), а электронное распределение описывается плотностью вероятности r(r).

35)ибридизация орбиталей — концепция смешения разных, но близких по энергии орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по энергии и форме. Гибридизация атомных орбиталей происходит при возникновении ковалентной связи между атомами. Гибридизация орбиталей очень полезна при объяснении формы молекулярных орбиталей и является интегральной частью теории валентных связей.
ГИБРИДИЗАЦИЯАТОМНЫХОРБИТАЛЕЙ, квантовохим. способ описания перестройки орбиталей атома в молекуле по сравнению со своб. атомом. Являясь формальным мат. приемом, гибридизация атомных орбиталей позволяет отразить нарушение сферич. симметрии распределения электронной плотности атома при образовании хим. связи. Сущность гибридизации атомных орбиталей состоит в том, что электрон молекулы вблизи выделенного атомного ядра характеризуется не отдельной атомной орбиталью (АО), а линейной комбинацией атомных орбита-лей с разл. значениями азимутального и магнитного квантовых чисел.
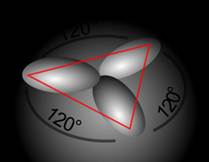
Sp2 Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей