рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Sp-гибридизация
Реферат Курсовая Конспект
Sp-гибридизация
Sp-гибридизация - раздел Химия, Направление протекания окислительно-восстановительных реакций во многом определяется реакцией среды Происходит При Смешивании Одной S- И Одной P-Орбиталей. Образуется Две Равноц...
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов
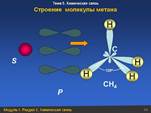
Одна s- и три р-орбитали смешиваются, и образуются четыре равноценные по форме и энергии sp3-гибридные орбитали
Только хлорид бериллия ВеCl2.
Два атома хлора оттягивают электроны от атома Ве и оба заряжаются отрицательно,
поэтому располагаются как можно дальше друг от друга, то есть по прямой Cl - Be -Cl.
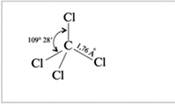
А четыре атома углерода как можно дальше в пространстве - это под углом 109°
к вершинам тетраэдра.
В метане углерод находится в состоянии sp3-гибридизации, и соответственно угол между этими орбиталями 109 с небольшим градусов, а в BeCl2 в атоме бериллия происходит sp-гибридизация и соответственно угол между такими орбиталями равен 180 гр.
CH4
CCL4
36) Механизмы образования ковалентной связи: обменный и донорно-акцепторный
Известно, что неметаллы взаимодействуют друг с другом. Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода:
Н+Н=Н2 DH=-436кДж/моль
Представим себе, что мы имеем два отдельных изолированных атома водорода. Ядро каждого из свободных атомов водорода окружено сферическим симметричным электронным облаком, образуемым 1s-электроном (см. рис. 5). При сближении атомов до
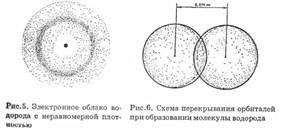
определенного расстояния происходит частичное перекрывание электронных оболочек (орбиталей) (рис. 6).
В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами; увеличение плотности отрицательного заряд» благоприятствует сильному возрастанию сил притяжения между ядрами и молекулярным облаком.
Итак, ковалентная связь образуется в результате перекрывания электронных облаков атомов, сопровождающегося выделением энергии. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания электронных облаков (образования молекулы H2) это расстояние составляет 0,074 нм (рис. 6). Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов. Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей. В результате возникновения химической связи между двумя атомами водорода каждый из них достигает электронной конфигурации атома благородного газа.
Изображать химические связи принято по-разному:
Возможен и другой механизм ее образования - донорноакцепторный. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого атома. Рассмотрим в качестве примера механизм образования иона аммония 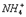 .
.
В молекуле аммиака атом азота имеет неподеленную пару электронов двухэлектронное облако):
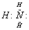 . .
|
У иона водорода свободна (не заполнена) 1s-орбиталь, что можно обозначить как □H+. При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, т.е. оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой
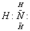
| + □H+ → | 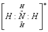
|
Заряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащее азоту, становится общим с водородом. В схемах изображение ячейки □ часто опускается.
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т.е. предоставляющий свободную орбиталь), называется акцептором.
37) Молекулярных Орбиталей Метод
квантовохимический расчетный метод,основанный на представлении о том, что каждый электрон молекулыописывается своей волновой функцией (молекулярной орбиталью, МО). Напрактике каждую молекулярную орбиталь часто представляют как линейнуюкомбинацию атомных орбиталей (приближение ЛКАО). Волновая функциямолекулы, построенная из молекулярной орбитали тем или иным способом,далее уточняется, напр. вариационным методом. Такой подход позволяетприближенно определить энергетические состояния молекулы, объяснить многиеее свойства и структуру.
Существуют разрыхляющие и связывающие МО. Их количество дает возхможность расчитать КРАТНОСТЬ связи и возможность существования молекулы или частицы.
Встречающиеся в органических соединениях кратные связи (двойные или тройные):
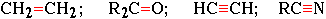
образуются при обобществлении двумя атомами более чем одной пары электронов:
Н2С : : СН2; R2С : : О; HС : : : CH; RС : : : N и т.д.
Кратные связи являются сочетанием σ- и π-связей.
Двойная связь состоит из одной σ- и одной π-связей и осуществляется 4-мя общими электронами.
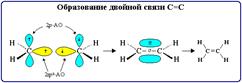
Тройная связь является комбинацией из одной σ- и двух π-связей и включает в себя шесть электронов.
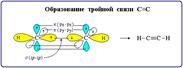
- Число электронных пар, участвующих в образовании ковалентной связи называется порядком связи.
Таким образом, порядок простой связи равен 1, двойной – 2, тройной – 3.
В случае сопряженных (делокализованных) связей (раздел 4.10) порядок связи отличается от этих целочисленных значений.
1. Поскольку молекулярные орбитали многоцентровые, они по форме сложнее атомных орбиталей. Рассмотрим пример построения простейших молекул по методу молекулярных орбиталей, например, водорода (Н2).
Образование МО из АО изображают в виде энергетических диаграмм. По вертикали откладывают значение энергии, которая возрастает снизу вверх. Рассмотрим энергетическую диаграмму построения молекулы водорода по методу МО. Из двух исходных АО (1s) получили две молекулярные орбитали: одну с меньшей энергией - связывающую и другую с большей энергией - разрыхляющую.
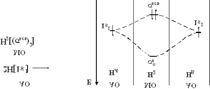
Согласно принципу минимума энергии, два электрона двух атомов водорода займут связывающую орбиталь с меньшей энергией, по запрету Паули спины электронов должны быть антипараллельны.
Согласно методу МО образование молекулы возможно только в том случае, если число электронов на связывающей орбитали больше, чем на разрыхляющей. В противном случае молекула не образуется. Кратность связи определяют по числу связывающих электронов по формуле
:N : N:
: :
точки это электроны. у каждого атома азота по 5 эл. по одному свободному и 4 спаренных. свободные эл. спариваются, это общая пара т.е. получилась молекула азота. образовалась молекулярная орбиталь. на связывающей орбитали 2 эл.
– Конец работы –
Эта тема принадлежит разделу:
Направление протекания окислительно-восстановительных реакций во многом определяется реакцией среды
Химическая термодинамика раздел физической химии рассматривающий термодинамические явления в области химии а также зависимости термодинамических... Т х базируется на общих положениях и выводах термодинамики и прежде всего... Калориметрия от лат calor тепло и лат metro измеряю совокупность методов измерения количества теплоты...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Sp-гибридизация
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов