рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Кислородсодержсшие соединения Фосфора.
Реферат Курсовая Конспект
Кислородсодержсшие соединения Фосфора.
Кислородсодержсшие соединения Фосфора. - раздел Химия, Важнейшие соединения бора, алюминия иах физико-химические свойства. КО и ОВ свойства. Борная кислота. Кристаллогидрат тетраборатанатрия /бура С Кислородом Фосфор Образует Полимерные Оксиды: /p2O...
С кислородом фосфор образует полимерные оксиды:
/P2O3 /x , /P2O5 /x , /P2O4 /x
Оксид P2O3 состоит из димерных молекул P4O6 , получается при сжигании фосфора в условиях недостатка кислорода и является летучим ве-ществом, плавится при 22,5 °С, возгорается при 250°С. Фосфористая кислота Н3РО3, оксид P4O6 и фосфиты - сильные восстановители. На воздухе они медленно окисляются, переходя при этом в фосфорную кислоту и ее производные. Процесс сопровождается свечением. Оксиды легко взаимодействуют с водой. Гидратация протекает в несколько стадий, и в результате получается целая серия полимерных кислот фосфора:
P4O10  / НРО3/п
/ НРО3/п  / Н4Р2О7/п
/ Н4Р2О7/п  / Н3РО4/п
/ Н3РО4/п
метафосфорная пирофосфорная ортофосфорная
Суть превращений заключается в разрыве связей Р-О-Р молекулами воды. По своему механизму реакция сходна с гидролизом.
= Р — О — Р = + Н2О  = Р — ОН + ОН — Р =
= Р — ОН + ОН — Р =
ǁ ǁ ǁ ǁ
О О О О
Первые стадии гидратации протекают мгновенно. Через некоторое время устанавливается равновесие между различными кислотами. Подобный механизм превращения оксидов фосфора в кислоты лежит в основе превращений АТФ /аденозинтрифосфорной кислоты/ в АДФ, АМФ.
Оксида фосфора /V/ P2O5 , или фосфорный ангидрид, образуется при горении фосфора на воздухе или в кислороде в виде белой объемистой снегообразной массы.
Оксид P4O10 образуется при нагревании других форм фосфора в избытке кислорода. P4O10 - белое вещество, отличающееся исключительной способностью поглощать влагу /поэтому его часто применяют для осушки газов/. С водой реагирует очень бурно и образует плохо растворимую в воде метафосфорную кислоту НРО3, которая при комнатной температуре медленно, а при кипячении быстро переходит в ортофосфорную:
P2O5 + Н2О  2НРО3
2НРО3
НРО3 + Н2О  Н3РО4
Н3РО4
Другие оксиды фосфора неустойчивы и получаются как промежуточные продукты окисления.
К числу важнейших кислот фосфора относятся мета-, орто- и пирофосфорные кислоты: НРО3, Н3РО4 и Н4Р2О7 .
Са3 /РО4/2 + 3H2SO4  3CaSO4 + 2H3PO4
3CaSO4 + 2H3PO4
При этом получается Н3РО4 в виде сиропообразного 85%-ного раствора. Чистая кислота — бесцветное кристаллическое вещество с
Тпл = 42°С , устойчива, не проявляет окислительных свойств. Н3РО4 -
3-х основная кислота, для нее известны средние фосфаты и гидрофосфаты: Na3PO4 ; Na2HPO4 ; NaH2PO4 . Основная масса фосфатов, в качестве удобрений, используется в народном хозяйстве.
При нагревании Н3РО4 отщепляется вода и образуется пирофос-форная кислота Н4Р2О7 — белое кристаллическое вещество:
t°
2Н3РО4  Н2О + Н4Р2О7
Н2О + Н4Р2О7
Эта кислота содержит группу Р-О-Р
О О
|| ||
ОН — Р — О — Р — ОН и является представителем пирокислот,
| |
ОН ОН
у которых атомы неметаллов связаны через кислород. Пирофосфорная кислота хорошо растворяется в воде и является несколько более сильной кислотой, чем Н3РО4
Ее соли — нирофосфаты - получают нейтрализацией кислоты или нагреванием кислых ортофосфатов. При нагревании Н4Р2О7 образуется метафосфорная кислота, которая склонна полимеризоваться:
Н4Р2О7  Н2О + 2НРО3
Н2О + 2НРО3
Точнее состав /НРО3/х, где х=3,4,5,6.
Эти кислоты образуются при добавлении воды к P4H10 и представляют густую вязкую массу, в которой, наряду с молекулами циклического строения, имеются и длинные молекулы, приближающиеся по составу к /НРО3/
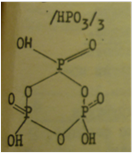 /HPO3/4
/HPO3/4
????????
O O
|| ||
OH —P— O— P —OH
| |
O O
| |
OH —P— O— P— OH
|| ||
O O
Метафосфорные кислоты ядовиты. Известны соли метафосфорных кислот - метафосфаты,
Вопрос: Какую биологическую роль выполняют фосфор и его соединения?
Ответ: В биологических системах содержится органические производные фосфора - аденозинтрифосфорная кислота /АТФ/, в молекуле которой органическое основание — аденозин - соединено с 3 остатками фосфорной кислоты; АТФ, являясь источником и переносчиком энергии в организме, может претерпевать следующие изменения:
ОН ОН ОН ОН ОН
| | | HOH | |
ОН — Р —О— Р —О— Р —O— CH2  АМФ + О=Р—О —Р=О
АМФ + О=Р—О —Р=О
|| || || аденозин | |
О 1 О 2 O 3 монофосфат ОН ОН
АТФ пирофосфорная кислота
Сначала разрывается связь I и АТФ переходит в АДФ /аденозиндифосфорная кислота/. Если в организме достаточно соединений фосфора, то присоединяя обратно группу Н2РО4, АДФ превращается в АТФ. Переход АДФ в АТФ в биологических системах служит для аккумулирования энергии, а обратный процесс АТФ  АДФ является источником энергия.
АДФ является источником энергия.
АТФ является коферментом, относится к макроэнргическим соединениям, за счет которых в организме протекает фосфорили-рование. При гидролитическом расщеплении высвобождается энергия, она используется при мышечных сокращениях, биосинтезе белков, нуклеиновых кислот, липидов. А в результате отщепления фосфатных групп в организме с участием АТФ происходит фосфорилирование других соединений. Таким образом, АТФ является универсальной формой — энергетически разменной "валютной" клетки.
Без фосфорорганических соединений не мог бы идти процесс обмен углеводов в ткани мозга. Фосфорсодержащий фермент фосфопилаза способствует не только распаду, но и синтезу полисахаридов в мозгу. В процессе окисления углеводов в ткани мозга важную роль играют дифосфопиридиннуклеотид и неорганический фосфат. Структурной основой фосфолипидов является фосфатидная кислота, которая представляат собой глицерин, этерифицированный двумя молекулами высших кислот и одной молекулой фосфорной кислоты. Глазная функция фосфолипидов сводится к обеспечиванию структуры мембраны, состоящей из белков и фосфолипидов. Большинство фосфор-органических соединений обладает биологической активностью. Поэтому одни из них находят применение как лекарственные препараты при лечении неврастений, переутомления нервной системы, малокровия /фитин, глицерофосфат кальция, липоцеребрин, фитоферолактам/. Другие - как средства борьбы с сельскохозяйственными вредителями и в военной промышленности /ВОВ/.
Растения накапливают фосфор и снабжают им животных. В организме животных фосфор сосредоточен главным образом в скелете, мышцах, нервной ткани. Из продуктов человеческого питания особенно богат фосфором желток куриных яиц.
В организме человека содержится в среднем около 1,5 кг элемента №15. Из этого количества 1,4 кг приходится на кости; около 130 г на мышцы, 12г на нервы и мозг. Почти все важнейшие физиологические процессы, происходящие в нашем организме, связаны с превращением фосфорорганических веществ. В состав костей фосфор входит главным образом в виде фосфата кальция. Зубная эмаль -это тоже соединения фосфора, которое по составу и кристаллическому строению соответствует важнейшему минералу апатиту Са5 /РО4/3 , /2F/ /2Cl/,поэтому техническая Н3РО4 широко применяется для производства эмалей и зубных пломб. Калиевые и натриевые соли фосфорной кислоты содержатся в тканевых жидкостях и крови, выполняя роль буферных систем. В земной коре встречается исключительно в виде соединений, это главным образом малорастворимые соли ортофосфорной кислоты.
На долю фосфора приходится 0,08% веса земной коры. По распространению он занимает 13-е место среди всех элементов.
Вопрос: Какое строение внешнего электронного уровня атомов р-элементов VI-А группы в нормальном и возбужденном состоянии и чему равны их степени окисления?
Ответ: Таблица 27
Строение внешнего электронного уровня атомов р-элементов VI-А группы.
| Элемент | Распределение электронов на внешних орбиталях | CО | |||
| Нормальное состояние | Возбужденное состояние | ||||
| О |              | -2, -1, 0, +2, | |||
| S , Se , Te, Po |             - - - - - - - - - - S P d
S P d 
      | -2, 0, +4, +6 | |||
| Изменение свойств простых веществ | газ твердые вещества —— ———————————— O S Se Te Po ———————————— —— неметаллы металл | ||||
На внешнем электронном уровне атомов этих элементов по 6 электронов, вследствие чего они имеют сильно выраженный неметаллический характер, электроотрицательность их выше, чем у элементов подгруппы азота.
В соединениях с водородом и металлами кислород, сера, селен и теллур проявляют степень окисления -2. Степень окисления кислорода в подавляющем большинстве соединений равна -2, т.к. по элект— роотрицательности он уступает только фтору. Степень окисления кислорода +2 наблюдается во фториде кислорода О+2 F2 -1.
Вопрос: Как изменяются КО и ОВ свойства соединений халькогенов? Ответ: С кислородом халькогены /S,Sе,Те/ образуют два ряда оксидов - ЭО2 и ЭО3, имеющие кислотный характер. Соединения со степенью окисления +4 являются кислотами средней силы. Кислоты типа Н2ЭО3 неустойчивы. В ряду H2SO3 - H2SeO3 - Н2ТеO3 происходит убывание кислотных свойств у теллуристой кислоты и появляются признаки амфотерности. Если H2SO3 — довольно сильный восстановитель, то для Н2ТеO3 характерно появление окислительных свойств. Такой же двойственный характер у их солей и оксидов ЭО2. Соединения со степенью окисления +6 имеют формулы H2SeO4, H2SO4, H6TeO6.
H2SeO4 H2SO4 H6TeO6 H2SO4 H2SeO4 H6TeO6


ослабление кислотных свойств усиление окислительных свойств
Водородные соединения Э -2 могут диссоциировать с отщеплением иона водорода. С увеличением радиуса ионов кислотные свойства усиливаются при переходе от H2S-----------------------------------  Н2Те
Н2Те
H2S ; H2Se ; H2Te

восстановительная способность увеличивается
Из всех водородных соединений молекулы воды наиболее полярны, поэтому склонны к ассоциации с образованием водородных связей. Вода наименее летучее соединение типа Н2Э и наиболее устойчивое в термическом отношении.
Вопрос: Какими свойствами обладают кислород и его соединения? Ответ: В силу наличия в молекуле кислорода неспаренных электронов он обладает парамагнитными свойствами:
.. .. .. ..
 О
О  +
+  О
О 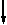

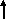 О
О 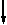
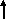 О
О 
.. .. .. ..
Аллотропное видоизменение кислорода - озон /О3/ - неустойчивое соединение, обладающее еще более сильными окислительными свойствами, чем молекулярный кислород:
2KI + О3  I2 + O2 + 2KOH
I2 + O2 + 2KOH
При малых концентрациях, запах у озона приятный, освежающий. Но если бы в воздухе оыл хотя бы 1% озона, то дышать этим воздухом было бы невозможно, потому что он весьма токсичен. Благодаря мощному окислительному действию озон может быть использован для дезинфекции, например, вместо хлора в процессе обеззараживания питьевой воды, а также для озонирования воздуха.
Кислород обладает ярко выраженными окислительными свойствами и образует оксиды почти со всеми элементами, а также соединяется с гемоглобином крови.
Свойства оксидов определяются положением элементов в периодической системе. В периоде слева направо в соответствии с изменением химической природы элемента изменяются их кислотно-основные свойства. Так, в случае оксидов элементов II периода в ряду:
Li2О BeO B2O3 ; CО2 ; N2О5
основной амфотерный кислотные оксиды
оксид оксид

ослабляются основные и усиливаются кислотные свойства.
Как известно, основные оксиды взаимодействуют с кислотными с образованием солей /комплексов/.
Zi2O + CO2  Zi2CO3
Zi2CO3
основной кислотный
оксид оксид
Оксиды S- и р-элементов — металлов, расположены в нижнем левом углу таблицы, имеют основные свойства, а оксиды р-элементов - неметаллов, находящихся в верхнем правом углу таблицы, — кислотные. Оксиды d-элементов в низких степенях окисления имеют основной характер. С увеличением степени окисления кислотные свойства оксидов d-элементов увеличиваются.
Для пероксидов характерно присутствие связи - О - О - /например, Nа-O-O-Nа; Н-О-О-Н, O-Ba-O /. Эти связи непрочны, поэтому пероксиды обычно легко выделяют кислород при нагревании или под действием кислот.
Вопрос: Почему в условиях высокогорья человеку "не хватает воздуха"? Какое биологическое воздействие кислород оказывает на организм?
Ответ: Человеку, впервые попавшему в горы, действительно на высоте "не хватает воздуха", а точнее кислорода, хотя относительная концентрация этого элемента в земной атмосфере с высотой практически не меняется. Но на высоте парциальное давление кислорода понижено. Причина "горной болезни" в том, что в разреженном воздухе кровь не успевает насытиться кислородом и наступает кислородное голодание. Организм людей, живущих в горных районах, приспособился к горным условиям. Интенсивнее протекают процессы кровообращения, организм вырабатывает больше гемоглобина. Этим компенсируется недостаточное парциальное давление кислорода в воздухе.
При повышенном давлении увеличивается содержание кислорода в крови. В барокамерах проводят сложнейшие хирургические операции, лечат некоторые формы сердечной недостаточности, повреждений мозга, почек, печени, легких и костных тканей, газовую гангрену, столбняк, иногда даже принимают роды.
Вопрос: Какие аллотрепные формы имеет сера?
Ответ: Сера имеет несколько аллотропных модификаций —S; S2 ; S4 ; S6; S8; различной структуры от линейных, зигзагообразных до циклических
Вопрос: Как изменяются КО и ОВ свойства соединений серы с изменением ее степени окисления?
Ответ: Сера является преимущественно окислителем и образует соеди нения почти со всеми элементами в соответствии с характерными для
серы степенями окисления от -2 /H2S/ до +6 /Н2SО4/
-2e -4e -2e
S -2  S0
S0  S+4
S+4  S+6
S+6
+2e +4e +2e
только окислители или восстанано- только
восстановитель витель окислитель
усиление окислительных свойств

H2S , сероводород, имеет неприятный запах и очень ядовит. Водный раствор сероводорода является слабой кислотой /KI = 1*10 -7
H2S — сильный восстановитель:
2H2S + 3O2 = 2SO2 + 2Н2О
Соли сероводородной кислоты — сульфиды. Сульфиды металлов I—A групп /S-элементов/ и аммония растворимы в виде, гидролизуются, образуя щелочную среду:
Na2S + НОН = NaHS + NаОН
S -2 + HOH = HS - + OH+ рH>7
Сульфиды других металлов нерастворимы в воде. Сульфиды неметаллов /р-элементов/являются тиоангидридами и обычно гидролизуются необратимо с образованием кислородсодержащей кислоты и сероводорода.
SiS2 + 3Н2О  H2SiO3 + 2H2S
H2SiO3 + 2H2S
Сульфиды - сильные восстановители. В зависимости от условий продуктами окисления сульфидов могут быть S , SO2, H2SО4:
Na2S + 4 Br2 + 4Н2О  H2SО4 +8HBr
H2SО4 +8HBr
Сера в виде простого вещества обладает окислительно —восстановительными свойствами / окислительно-восстановительной двойственностью/:
окислитель  S0 + Zn = ZnS -2
S0 + Zn = ZnS -2
восстановитель  S0 + 2HNO3 = H2+6 SO4 +2NO
S0 + 2HNO3 = H2+6 SO4 +2NO
SO2 /СО +4/ - диоксид серы, сернистый ангидрид, соответствующие ему слабая сернистая кислота H2SО3 и ее соли сульфиты проявляют окислительно— восстановительную двойственность:
S+4O2 + H2S  3S0 + 2Н2О
3S0 + 2Н2О
окислитель
S+4O2 + O2  S+6O3
S+6O3
восстановитель
H2SО3 + 2H2S  3S0
3S0 + 3Н2О
+ 3Н2О
окислитель
5K2S+4O3 +2КМnO4 + 3H2SО4  6К2SО4 + 2МnSО4 + 3Н2О
6К2SО4 + 2МnSО4 + 3Н2О
восстановитель
4K2SO3  K2S +3K2SO4
K2S +3K2SO4
При кипячении раствора сульфита натрия с порошком серы образуется тиосульфат натрия
t°
Na2SO3 + S  Na2S2O3 ,
Na2S2O3 ,
которые имеет следующую графическую формулу:
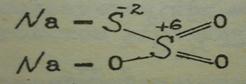
Na — S -2 O ????????????????
S+6
Na — O O
Тиосульфат натрия обладает восстановительными свойствами благодаря наличию атомов серы в двух разных степенях окисления +6 и -2.
Восстановительные свойства тиосульфата натрия применяют в количественном анализе в методе иодометрии:
2Na2S2O3 + I2  Na2S4O6 + 2NaI
Na2S4O6 + 2NaI
2S2O3 -2 — 2е  S4O6 -2
S4O6 -2
I2 + 2е  2I -
2I -
При действии на тиосульфат натрия серной кислотой выделяется неустойчивая в водном раотворе тиосерная кислота:
Na2S2O3 + H2SО4  Na2SO4 + H2S2О3
Na2SO4 + H2S2О3
H2S2О3  Н2О + SО2 + S
Н2О + SО2 + S
Триоксид серы SО3 /серный ангидрид /СО +6/ получается при каталитическом окислений SО2, с водой образует сильную серную кислоту H2SО4 .
При растворении SO3 в концентрированной серной кислоте получается ряд полисерных кислот.
H2SО4 + SO3  H2S2О7 двусерная кислота
H2S2О7 двусерная кислота
H2SО4 + пSO3  H2SО4 • пSO3 полисерная кислота
H2SО4 • пSO3 полисерная кислота
Смесь серной и различных полисерных кислот - густая маслянистая
жидкость /олеум/.
H2SО4 - только окислитель /H+ ,S+6 /. Наличие в молекуле атомов двух элементов, способных принимать электроны усложняет поведение H2SО4 в реакциях; в разбавленных растворах H2SО4 является окислителем за счет катионов Н+ и взаимодействует только с металлами, стоящими в ряду напряжений до водорода, с образованием водорода:
H2SО4 (разб.) + Мg = МgSО4 + H2
2H+ + 2е  H20 /окислитель/
H20 /окислитель/
Мg0 —2е  Мg+2 /восстановитель/
Мg+2 /восстановитель/
В концентрированных растворах H2SО4 является окислителем за счет атомов серы и восстанавливается до соединений серы с меньшими
степенями окисления:
+S; C ; P ; Cu ; Ag +2e
H2SO4конц.  S+4O2
S+4O2
+Na ; Ca ; HI +8e
H2SO4конц.  H2S -2
H2S -2
+Zn ; Ng +8e, +2e , +6e
H2SO4конц.  H2S -2 , S+4O2 , S0
H2S -2 , S+4O2 , S0
При обычной температуре с концентрированной серной кислотой
не взаимодействуют железо, хром, алюминий /явление пассивации/.
Вопрос: Какие препараты серы применяются в медицине?
Ответ: Препараты серы применяются в качестве слабительных, от-
харкивающих, серных мазей при ряде кожных заболеваний. Прием
сероводородных ванн благоприятно влияет на организм при различ-
ных патологических состояниях.
Пентагидрат тиосульфата натрия NaS2О3 • 5H2O применяют как противоядие при отравлениях цианидами, синильной кислотой, солями тяжелых металлов, иодом. В санитарной гигиене это соединение используется для удаления остатка хлора после отбеливания тканей /бинты, вата и т.д./.
Na2S2О3 в виде 30% раствора применяется как антисептическое средство, при аллергических заболеваниях, артритах, невралгии, красной волчанке. Наружно тиосульфатом лечат чесотку, грибковые заболевания кожи.
H2SО4 применяется как противоядие при отравлениях солями бария и свинца, для подкисления микстур. Определение сульфатов в моче позволяет судить о процессах гниения белков в кишечнике, а в воде используется для оценки ее качества.
Вопрос: Роль серы в организме?
Ответ: Сера входит в состав сульфгидрильных групп белка и дофермента - А, выполняющего важную роль в обмене жиров, углеводов. Благодаря наличию SН - групп в молекуле аминокислоты цистеина, в белках образуются дисульфидные мостики - S - S-, участвующие в построении третичной структуры белка.
Сера входит в состав аминокислоты метионина, придавая ей специфические биологические свойства, в составе серу содержащих аминокислот, является строительным материалом гормонов, ферментов и др. биологически активных веществ.
H2SО4 используется для обезвреживания ядовитых веществ, образующихся в толстом кишечнике в результате гниения белков пищи.
Вопрос: Какое электронное строение имеют р-элементы VII-А группы в нормальном и возбужденном состоянии?
Ответ: Таблица28
Электронное строение р-элементов VII-А группы в нормальном и возбужденном состоянии
| Элемент | Основное электронное состояние | Возбужденное электронное состояние | СО | Валентность |
| F |        |        | -1 | |
| Cl, Br, I |
       |                             | от -1 до +7 | I III V VII |
Вопрос: Сравните окислительную способность галогенов.
Ответ: Свободные галогены - очень энергичные окислители. Эта способность проявляется при взаимодействии их с простыми /Н2, S,Р,Si, Na,Мg,А1/ и некоторыми сложными веществами.
2Аl + 3Вr2 = 2А1Вr3
2P + 3Cl2 = 2PCl3
Br2 + MnO2 + NaOH = Na2MnO4 + 2NaBr + 2H2O
I2 + H2S = S + 2HI
Окислительная активность последовательно уменьшается от фтора к астату. Этот эффект проявляется в способности предыдущего галогена в свободном состоянии окислять отрицательный ион последующего.
2КВr + Cl2 = Br2 + 2КCl
2КI + Br2 = I2 + 2КВr
Таким образом, по окислительной способности галогены можно расположить в ряд: F2 > С12> Вr2 > I2.
Вопрос: Как изменяются КО и ОВ свойства кислородсодержащих кислот в зависимости от степени окисления галогенов?
Ответ: Хлор, бром, иод, образуют следующие кислородсодержащие кислоты:
| СО | +1 +3 +5 +7 |
| HClO HClO2 HClO3 HClO4 хлорноватистая хлористая хлорноватая хлорная соли-гипохлориты соли-хлориты соли-хлораты соли-перхлораты HBrO HBrO3 бромиоватистая бромноватая соли-гипобромиты соли-броматы HIO HIO3 H5IO6 иодоватистая иодоватая иодная соли-гипоиодиты соли-иодаты соли-периодаты |
Кислоты Н Hal О - нестойкие, быстро разлагаются, сравнительно устойчивы в разбавленных водных растворах, являются слабыми кислотами и сильными окислителями. В ряду HCl/p/ HBrO/p/ HIO/p/ сила кислот и окислительная способность снижается. Соли этих кислот устойчивы, являются сильными окислителями
Кислоты Н Hal О3/р/ - сильные кислоты, практически диссоциируют полностью, сильные окислители. В ряду HCl3, HBrO3, HIO3 сила кислот и окислительная способность уменьшается. Их соли при нагревании действуют как сильные окислители, водные растворы солей окислительной способностью на обладают. В ряду HCl4, H5IO6 сила
кислот снижается.
С увеличением степени окисления галогенов снижаются основные свойства кислородных кислот, устойчивость и кислотные свойства увеличиваются. Окислительная способность уменьшается.
Наибольшее значение имеют кислородные соединения хлора.
КСlO3 /бертолетова соль/ - очень сильный окислитель, при нагревании разлагается:
MnO2
2КСlO3  2КСl + 3O2
2КСl + 3O2
4КСlO3  КСl + 3КСlO4
КСl + 3КСlO4
При пропускании хлора через раствор Са/ОН/2 образуется смесь, называемая хлорной /белильной/ известью.
2С12 + 2Са/ОН/2 = CaCl2 + Ca/OCl/2 + 2H2O
или
С12 + Са/0Н/2 = CaOCl2 + H2O
ионная форма
С12 + 2ОН - = Cl - + OCl - + H2O
Хлорная известь - сильный окислитель, обладает отбеливающим действием за счет хлорноватистой кислоты /НСlO/, которая получается при действии углекислоты воздуха /СО2/ на белильную известь:
Ca/OCl/2 + СО2 + H2O = СаСО3 + 2НСlO
Ca/OCl/2 - белый порошек с запахом хлора. Содержание активного хлора должно быть не менее 32%. При действии на CaOCl2 соляной
кислотой выделяется хлор:
CaOCl2 + 2HCl = CaCl2 +Cl2 + H2O
На этом основано ее применение для отбеливания и дезинфекции. Хлор растворяется в воде. При комнатной температуре один объем воды растворяет около 2,5 объемов хлора. Раствор хлора в воде называют хлорной водой. При растворении хлора почти половина его диспропор-ционирует в воде, образуя две кислоты — соляную и хлорноватистую
/HCl и НСlO /:
Сl20 + H2O  НСl -1 + НСl+1O
НСl -1 + НСl+1O
Хлорноватистая кислота неустойчива, даже в разбавленном растворе
распадается НСlO=НС1 + O, выделяя атомарный кислород, обладающий
большой реакционной способностью. Поэтому хлорная вода является сильным окислителем и применяется для беления, дезинфекции.
Вопрос: Как взаимодействуют галогены с водородом и каковы основные
свойства галогеноводородов?
Ответ:
F2 |  2HF + 128 ккал,реагирует со взрывом в темноте
2HF + 128 ккал,реагирует со взрывом в темноте
Cl 2+ H2 |  2HCl + 44 ккал, реагирует со взрывом на свету
2HCl + 44 ккал, реагирует со взрывом на свету
Br2 |  2HBr + 8 ккал,реагирует при нагревании
2HBr + 8 ккал,реагирует при нагревании
I2 |  2HI + 6 ккал
2HI + 6 ккал
Галогеноводороды - бесцветные газы, с резким запаxoм, хорошо растворимые в воде. При растворении протекают процессы:
HNaI/г/ + Н2O/ж/  H3О+ /р/ +NаI - /р/ /HCl+Н2О
H3О+ /р/ +NаI - /р/ /HCl+Н2О  H3О+Cl - / Водные растворы водородных соединение являются кислотами:
H3О+Cl - / Водные растворы водородных соединение являются кислотами:
HF - фтороводородная /плавиковая/, HCI - хлороводородная /соляная/,
НВr - бромоводородная, HI —иодоводородная, диссоциируют по типу: HNaI  H+ + NaI - . Молекула HF сильно полярна, имеет большую склонность к ассоциации за счет водородных связей с образованием полимеров H2F2 ;Н3Г3 ;H4F4 ;H5F5 ;H6F6. Ассоциированные молекулы HF в водных растворах диссоциируют в меньшей степени, поэтому фтороводородная кислота — слабая, немного сильнее уксусной.
H+ + NaI - . Молекула HF сильно полярна, имеет большую склонность к ассоциации за счет водородных связей с образованием полимеров H2F2 ;Н3Г3 ;H4F4 ;H5F5 ;H6F6. Ассоциированные молекулы HF в водных растворах диссоциируют в меньшей степени, поэтому фтороводородная кислота — слабая, немного сильнее уксусной.
/КдHF = 7,0 • 10 -4/. HCl, НВr, HI- сильные кислоты, сила их увеличивается за счет уменьшения прочности связи Н-NаI /НI >НВr >НС1/.
Отрицательные ионы галогенов, за исключением фторид-иона, - восстановители. Восстановительная способность водородных кислот в ряду HCl - НВr - HI увеличивается. Это связано с уменьшением окислительно-восстановительных потенциалов E°Cl2 /С1- =1,36, Е°Вr2 /2Вr - =1,07,
Е°- I2 /2I - =0,54. HI- сильный восстановитель.
Вопрос: Какими свойствами обладают галиды?
Ответ: Практическое значение имеют соединения галогенов с металлами I-VIII групп. Общее название их - галогениды или галиды.
Галиды - в основном твердые кристаллические вещества с высокими температурами плавления. Растворимость в воде изменяется следующим образом: иодид>бромид >хлорид >фторид. Понижение растворимости в этом ряду объясняется изменением энергии кристаллической решетки, которая с уменьшением ионного радиуса галогена возрастает. Этот порядок соблюдается у галидов щелочных и щелочноземельных металлов.
Большинство хлоридов, бромидов, иодидов хорошо растворимы в воде, исключение составляют соли: Ag+, Аи+, Сu+2, Pb+2
Из фторидов растворимы соли K+;Na+;Ag+;Hg+, за исключением солей
Ca+2; Mg+2; Pb+2; Cu+2; Zn+2.
Связь в галидах /ионная, ионно-ковалентная/ в ряду фторид-хлорид-бромид-иодид для одного и того же элемента ослабевает, наблюдается общее уменьшение устойчивости соединений и увеличение восстановительных свойств.
Галиды щелочных и щелочноземельных металлов в основном гидролизу не подвергаются, галиды амфотерных и некоторых тяжелых металлов гидролизуютси в водных растворах:
AlCl3 + НОН — Al/OH/2CI + HCl I ступень
Вопрос: Каково участие галогенов в комплексообразовании?
Ответ: Ионы галогенов в степени окисления /-1/ склонны к процессу комолексообразования и входят в состав внутренней сферы комплексного соединения в качестве лигандов, реже — в состав внешней сферы. Координационные числа по фтору для элементов 2 периода равны 4, для элементов других периодов -6, по хлору, брому, иоду координационное число равно 4, реже -6. Примеры комплексных ионов:
[BeF4] -2 ; [Si F5] -2 ; [AlCl4] - ; [HgI4] -2.
Вопрос: Какую биологическую роль выполняют галогены?
Ответ: Все галогены — микробиогенные элементы.Уставовлено , что фтор стимулирует ряд физиологических процессов, образование opганических соединений фосфора в печени и почках, связывание тканями фосфата кальция, уменьшает рост зубов, челюстных костей, ускоряет кальцинацию костной ткани, препятствует развитию остемиелита, уменьшает кариес зубов. Определенные концентрации фтора оказывают благоприятное действие на рост волос, зубов. Фтор оказывает влияние на ферментные процессы, обмен углеводов и жиров. Во многих биохимических процессах фтор выступает, как ингибитор. Он угнетающе действует на щитовидную железу. При недостатке фтора в организме развивается кариес зубов, при высоких концентрациях /свыше 20-150 мг на 1 кг живого веса/ - острые отравления. Длительное поступление в организм соединений фтора вызывает флюороз /разрушение зубов/. В организме F концентрируется в виде неорганических веществ, главным образом в коже, волосах, ногтях и особенно в зубах и костях.
Физиологическое действие фтора объясняют взаимодействием его с
водой:
Н2О + F2  2HF + ''O''
2HF + ''O''
Атомарный кислород и плавиковая кислота разрушают ткани слизистых оболочек.
С1- - регулятор некоторых ферментативных реакций/активирует амилазу/, водного я солевого обмена, осмотического давления жидкости, кислотно-щелочного равновесия тканей. HCl присутствует в желудочном соке, необходима для нормального пищеварения. Ионы С1- участвуют в возникновении потенциала клеточных мембран. С12 - газ, ядовит, вызывает поражение дыхательных путей.
Вr - регулирует процессы возбуждения и торможения ЦНС, содержится преимущественно в гипофизе, крови, спинномозговой жидкости. Бром в чистом виде /Вr2/ сильно раздражает слизистые оболочки, вызывает головокружение, удушье, поражает легкие, на коже вызывает ожоги.
Общее содержание иода в организме человека составляет примерно 25 мг, около половины этого количества сосредоточено в щитовидной железе, небольшое количество содержится в крови. Иод регулирует процессы роста, скорость обмена веществ, участвует в синтезе тироксина. Гормоны, содержащие иод, ускоряют окислительные процессы, влияют на общее физическое и психическое развитие. При недостатке иода в воде у человека развивается эндемический зоб. Пары I2 ядовиты.
Вопрос: Какие соединения галогенов применяются в медицине?
Ответ: NaF применяется в стоматологии для лечения зубов, при парадонтозе, эндокринных заболеваниях, ревматизме, туберкулезе, эпилепсии и т.д. Фторпан, трифтортирозин, фторпиримидин, фторметасарколизин - вещества, обладающие высокой противоопухолевой активностью. Фторотан, флюорол - эффективные средства для ингаляционного наркоза. Бромиды К,Nа, Ca и органические бромприозводные применяются в качестве снотворных и успокаивающих средств. В медицинской практике находят применение ряд препаратов хлора, большая часть которых используетвя в качестве бактерицидных средств, бактерицидная активность ионов С1 - обеспечивается способностью его атомов денатурировать белки при соединении с аминогруппами.
Соляная кислота в определенной концентрации применяется в качестве лечебного средства при недостаточной кислотности желудочного сока. Хлор входит в различные препараты, рассмотренные в других разделах пособия.
В медицине применяют элементарный /свободный/ иод в качестве антисептического средства, для обработки ран, подготовки операционного поля в виде /5-10%/ спиртовых растворов. KI, NаI применяются при энедемическом зобе, заболеваниях глаз, горла, бронхиальной астме. Таблетки иодида калия /антиструмии/ или "йодистые таблетки" применяют для предупреждения эндемического зоба.
– Конец работы –
Эта тема принадлежит разделу:
Важнейшие соединения бора, алюминия иах физико-химические свойства. КО и ОВ свойства. Борная кислота. Кристаллогидрат тетраборатанатрия /бура
Содержание темы и учебно целевые вопросы... Общая характеристика р элементов Неметаллы амфотерные элементы Изменение... Элементы III А группы и IV А группы Общая характеристика групп...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Кислородсодержсшие соединения Фосфора.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов