рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Важнейшие соединения бора, алюминия иах физико-химические свойства. КО и ОВ свойства. Борная кислота. Кристаллогидрат тетраборатанатрия /бура
Реферат Курсовая Конспект
Важнейшие соединения бора, алюминия иах физико-химические свойства. КО и ОВ свойства. Борная кислота. Кристаллогидрат тетраборатанатрия /бура
Важнейшие соединения бора, алюминия иах физико-химические свойства. КО и ОВ свойства. Борная кислота. Кристаллогидрат тетраборатанатрия /бура - раздел Химия, Р—Элементы И Их Соединения ...
Р—элементы и их соединения
Содержание темы и учебно-целевые вопросы
Общая характеристика р-элементов. Неметаллы, амфотерные -элементы.Изменение неметаллических свойств в соответствии с периодическим законом Менделеева.
Элементы III—А группы и IV— А группы. Общая характеристика групп.
Важнейшие соединения бора, алюминия иах физико-химические свойства. КО и ОВ свойства. Борная кислота. Кристаллогидрат тетраборатанатрия /бура/.
Важнейшие соединения элементов IV—А группы: оксиды, гидроксиды, кислоты, соли, физико-химические свойстваважнейших соединений. КО и ОВ свойства. Оксид и диоксид углерода. Их биологическая активность. Угольная кислота и ее соли. Простые и комплексные соединения. Диоксид кремния. Кремниевые кислоты и силикаты.
Соединения бора, углерода, кремния в организмах, их биологическая роль, применение в медицине.
Элементы V-А группы. Общая характеристика группы.
Важнейшие соединения азота и их физико-химические свойства. Изменение КО и ОВ свойств азота с изменением степени его окисления.Аммиак. Соли аммония. Свойства аминокислот как производных аммиака. Оксиды азота, их токсическое действие. Азотистая и азотная кислота, нитриты и нитраты.
Важнейшие соединения фосфора и их физико-химические свойств Аллотропия фосфора. Изменение КОи ОВсвойства соединений фосфор с изменением его степени окисления.
Фосфин. Оксиды фосфора. Фосфористая и фосфорнаякислоты,стереохииия молекул. Орто-, мета-, пиро- фосфаты. Свойства АДФ и АТФ как производных ди— и три—фосфорной кислоты.
Биологическая роль азота, фосфора, применение их соединений в медицине.
Элементы VI—А группы. Общая характеристика группы. Халькогены.
Кислород. Озон. Оксиды, кислородсодержащие кислоты, основания, соли - закономерности изменения физико-химических свойстви соответствии спериодической системойД.И.Менделеева.
Биологическая роль кислорода. Применение кислорода и озона в медицине.
Важнейшие соединения серы и их физико-химические свойства. Аллотропиясеры. Изменение КО и ОВ свойств соединений серы с изменением ее степени окисления. Важнейшие соединения серы.
Биологическая роль соединений серы. Применение в медицине соединений серы.
Элементы VII-А группы. Общаяхарактеристика группы.
Галогены, галогениды - закономерности изменения физико-химических свойств всоответствии с периодиаеской системой Менделеева.Галогеноводородные кислоты, изменения КО и ОВ свойств в группе.Кислородные кислоты хлора, изменение КО и ОВ свойств с изменением степени окисления. Хлорная /белильная/ известь. Хлорная вода. Бертолетова соль.
биологическая роль соединений фтора, хлора, бромаи йода, их применение вмедицине.
3.2. Вопросы и ответы по разделу "Р—элементы и их соединения".
Вопрос:Какое положение занимают р—элементы в ПСЭ?
Ответ: Р—элементы расположены в ПСЭ в главных подгруппах с III по VII групп, а также к ним относятся элементы VIII-А группы, за исключением гелия. Р—элементы завершают короткие и длинные периоды. В атомах этих элементов происходят заполнение электронами внешних р-орбиталей /с пs2 прI — пs2 пp 6 подуровень/. Всего в таблице Д.И.Менделеева 30 р-элементов.
Пятнадцать р-элементов — типичные неметаллы, они занимают в ПСЭ верхний правый угол, образуя треугольник, вершиной которого является фтор, а основанием — линия, проходящая через элементы бор — астат.
III гр. - В,
IV гр. - С,Si ,
V гр. - N, Р, As,
VI гр. - О, S, Se, Те,
VII гр. - F, CI, Вr, Y, At
Остальные десять элементов являются типичными металлами и близкими по свойствам к ним, в ПСЭ располагаются
Ш гр. - AI, Gа, In, Те,
IV гр. - Ge, Рв, Sn,
V гр..- Sb, Bi,
VI гр. - Ро. '
Германий и сурьма обладают и металлическими и неметаллическими свойствами, оксиды и гидроксиды р-элементов /А1,Gа, In, Sn, Рв, As, Sb/ являются амфотерными.
Вопрос: Как происходит изменение радиусов атомов р-элементов, потенциалов ионизации, электроотрицательности, неметаллических и металлических свойств простых веществ в группах р-элементов.
Ответ: В группе /табл. 18/ с ростом порядкового номера элемента,
по мере появления новых энергических уровней происходит возрастание радиусов атомов, уменьшение энергии ионизации и электроотрицательности. При этом связь электрона с ядром становится слабее у последующего элемента, чем у предыдущего. В таком состоянии легко происходит отрыв электронов и атом превращается в катион, т.е. происходит усиление металлических свойств.
Таблица 18
Некоторые свойства элементов VI А группы
| Элемент | O | S | Se | Te | Po |
| Ковалентный радиус атома, А0 | 0,73 | 1,04 | 1,16 | 1,43 | |
| Энергия ионизации ЭВ | 13,6 | 10,36 | 9,7 | 9,01 | 8,43 |
| Электроотрицательность по Полингу | 3,4 | 2,6 | 2,5 | 2,0 | |
| Изменение свойств простых веществ | Газ твёрдые вещества
— ————————
O S Se Te Po
—————————— ——
Неметаллы металл
 Усиление металлических свойств
Усиление металлических свойств
|
Вопрос: Как происходит изменение радиусов атомов, потенциалов ионизации, электроотрицательности, неметаллических и металлических свойств простых веществ р-элементов по периодам?
Ответ: В периоде /табл. 19,2 0/ слева направо по мере увеличения заряда ядра происходит уменьшение радиусов атомов, возрастание энергии ионизации и электроотрицательности. Ослабляются металлические и усиливаются неметаллические свойства простых веществ р—элементов.
Таблица 19
Некотрые свойства элементов II периода
| II период |
| Элемент ! B ! C ! N ! O ! F |
| Ковалентный 0,89 0,77 0,74 0,73 0,72 радиус атома, А0 |
| Энергия ионизации 8,29 11,26 14,53 13,61 17,42 ЭВ |
| Электроотрицательность 2,0 2,5 3,0 3,4 4,0 по Полингу |
Изменение свойств твёрдые ве-ва газ
простых веществ B C N O F
 Усиление неметаллических свойств
Усиление неметаллических свойств
|
Таблица 20
Некоторые свойства элементов III периода
| III период |
| Элемент ! Al ! Si ! P ! S ! Cl |
| Ковалентный 1,43 1,17 1,11 1,04 0,99 радиус атома, А0 |
| Энергия ионизации ,98 8,1 10,49 10,36 1,97 ЭВ |
| Электроотрицательность 1,61 1,90 2,19 2,58 3,16 по Полингу |
Изменение свойств твёрдые ве-ва газ
простых веществ Al Si P S Cl
металл ———————————————
неметаллы
 Возрастание неметаллических свойств
Возрастание неметаллических свойств
|
Вопрос: Обладает ли р-элементы способностью к комплексообразованию?
Ответ: Ионы р-элементов склонны к образованию внутрикомплексных соединений с рядом органических реагентов. В процессе комплексообразования с неорганическими реагетнами они входят в состав внутренней сферы в виде комялексоообразователей или лиганда, а также могут образовывать внешнюю сферу. Например, Na3 [Al /OH/6] ; Na2 [SiF6]; [Ag /NH3/2]CI. Комплексообразующая способность р-элементов связана с наличием у ионов металлов свободных квантовых ячеек на р и S -орбиталях и неподеленных электронных пар у ионов неметаллов.
Вопрос: Каково строение внешнего электронного уровня в нормальном и возбужденном состоянии атомов р—элементов III-А группы и чему равны их степени окисления?
Ответ: Атомы р-элементоз II периода во внешнем электронном уровне /слое/ имеют S и р-орбитали. Атомы р-элементов с III по VI периоды имеют, помимо S , р и d орбитали, что в общем случае приводит к возрастанию их валентных возможностей. Как правило, максимальная валентность р-электронов соответствует номеру группы
Таблица 21
Строение внешнего электронного уровня в нормальном
и возбужденном состоянии атомов р-элементов III-А группы,характерные СО.
| Элементы III-А группы | Распределение электронов на внешних орбиталях | СО | |
| Нормальное состояние | Возбужденное состояние | ||
|
В |    — — — —     — — | /+1/, +3,/ -3 / | |
| Al,Ga,In,Tl |    - - - - - - - - - - - - - -     | /+1/, +3,/ -3 / | |
| Изменение свойств простых веществ | В Al Ga In Tl
неметалл амфотерный металл металлы
 Усиление металлических свойств
Усиление металлических свойств
| ||
Для элементов подгруппы бора /за исключением ТI/ характерна степень окисления+3. Для TI характерна степень окисления+1, при чем TIОH является сильным основанием. Это объясняется тем, что для TI более прочным оказываются соединения, в которых атом сохраняет спаренные электроны на S-орбиталях и валентным становится р-электрон. Отрицательная степень окисления бора проявляется крайне редко, например, в гидридах бора- бораны ВпНп + 4 , ВпНп + 6.
Вопрос: Как изменяются кислотно-основные свойства соединений р-элементов III—А группы?
Ответ:Все элементы III-А группы образуют оксиды типа R203 и соответствующие им гидроксиды, основные свойства которых в подгруппах растут сверху вниз /табл. 22/
Таблица 22
Изменение КО свойств соединений элементов III-А группы
| Элемент ! Оксиды ! Кислоты ! Амфолиты ! Основания |
| В B2O3 -кислотный HBO2 ,HBO3 — — Al Al2O3 -амфотерный — Al /OH/3 — Ga Ga2O3 -амфотерный — Ga/OH/3 — In In2O3 -слегка амфотерный — In /OH/3 основные свойства преобладают над кислотными |
| Tl Tl2O3 -основной Tl/OH/3 -слабое Tl2O -основной — — Tl/OH/3-сильное |
Вопрос: Охарактеризуйте способность элементов III-А группы к комплексообразованию.
Ответ: Ионы /Э+5/ элементов IIIА группы способны к процессу компленсообразования /проявляют акцепторное свойства/ за счет участия в образовании координационных связей свободных S и р-орбиталей в Sр3 —гибридизации /В, АI/, при этом координационное число равно 4, S, p3 d2-гибридизации / AI, Yn, TI, Уа /S,р и d-орбиталей с координационным числом 6.
Вопрос: Каковы основные химические свойства бора и его важнейших соединений?
Ответ: В обычных условиях бор, подобно кремнию, весьма инертен и непосредственно соединяется только со фтором:
2B + ЗF2 —> 2BF3
При нагревании бор реагирует со многими веществами, вступая в реакции как в роли окислителя, так и восстановителя.
В+ неметаллы /О, S ,CI2, N2 /, например, 4В + 3О2= 2В2О3 восстановитель
В + металлы, например, В + Mg = Мg3В2
окислитель " «
Бор реагирует со сложными веществами:
2В +3H2O —> B2O3 + 3Н2
В + 3НNO3 —>Н3ВO3 + 3NO2
2B + 2NaOН + 2H2O —>2 NaBO2 + 3H2
С водородом бор непосредственно не взаимодействует, бораны получают действием воды или кислоты на бориды:
2Mg3B2 + I2Н2O —> 2В2Н6 + 6Мg/0Н/2
Mg3B2 + 6HCI —> В2Н6 + 3МgСl2.
Характер связей бора в соединениях ковалентный.
Бор способен и к реакциям комплексообразования, находясь в ссстоянии Sp3 -гибридизации / K [BF4] /.
Наибольшее практическое значение имеют кислородные соединения бора.
Оксид бора, борный ангидрид В203 - бесцветная, стекловидная масса. С водой образует ортоборную кислоту- B2O3 + 3Н2О =2Н3ВО3.
Безводная Н3ВО3 - бесцветные, чешуйчатые кристаллы, плохо растворяются в холодной воде при нагревании растворимость повышается. Н3ВО3 - очень слабая кислота, слабее H2CO3 и H2S
В растворе Н3ВО3 диссоциирует, проявляя кислую реакцию-Н3ВО3  Н+3 + Н2ВО3- КI = 6.10-10 /1-я ступень/
Н+3 + Н2ВО3- КI = 6.10-10 /1-я ступень/
Н2ВО3  Н+3 + НВO3-2 К2=2.10-13 /1-я ступень/
Н+3 + НВO3-2 К2=2.10-13 /1-я ступень/
НВО3  Н+2 + BO3-3 К3 =2.1 0-14/3-я ступень/
Н+2 + BO3-3 К3 =2.1 0-14/3-я ступень/
или
Н3ВО3 + НОН = В/ОН/4 - + Н + К = 1.10-9
При нагревании Н3ВО3 постепенно теряет Н2О, превращаясь в B2O3
н3во3 ---------> нво2 ----------------> н2в4о7 -------------> в2о3
ортоборная метаборная тетраборная борный ангидрид
/пирофорная /
Ортоборная кислота — самая стойкая из борных кислот, но соли ортобораты не образует. Соли борных кислот - бораты - большей частью являются производными мета- чаще тетраборной кислот.
4Н3В03 + 2NаОН  Nа2В4О7 + 7Н20
Nа2В4О7 + 7Н20
4Н3В03 + 2 ОН -  В407 -2 + 7Н20
В407 -2 + 7Н20
Кристаллогидрат татрабората натрия /буря/ Na2B4O7 • IOH2O -бесцветные кристаллы; его водные растворы вследствие гидролиза обладают сильной щелочной реакцией:
Nа2В407 + 7H20 = 2NаОН + 4Н3В03
В407 -2 + 7Н20 = 20Н - + 4Н3В03
Вопрос: Какова биологическая роль бора, применение его соединений в медицине?
Ответ: Бop для живых организмов жизненно важный микробиогенный элемент. Он влияет на белковый и углеводный обмен животных и растений. Концентрируется в костях, зубах, мышцах, в костном мозгу и щитовидной железе животных, и, вероятно, ускоряет рост и развитие организмов. Установлено, что бор тормозит кишечную амилазу и кишечные протеиназы, усиливает действие инсулина и тормозит окисление адреналина, ослабляет действие витаминов В2 и B12. Для химии организма важную роль играют сильнейшие акцепторные свойства бора. Из соединений бора в медицине в основном используют ортоборную кислоту - Н3В03 - растворы /водные, спиртовые/ применяют наружно, для полоскания рта, зева, для промывания глаз, в виде мази и в примочках при заболеваниях кожи.
Тетраборат натрия Nа2В407 • IOH2O - растворы /водные, гли-цириновые/ применяют наружно как антисептическое средство для полосканий, смазываний. Внутрь - при лечении больных эпилепсией.
Вопрос:Какими химическими свойствами обладает алюминий?
Ответ: Химически активен, является сильным восстановителем.
Fe203 + 2А1 = 2AI203 + 2Fe
реагирует с кислородом: 4AI + 302 = 2AI203 галогенами: 2AI + 3С12 = 2 А1С13
при высокой температуре - с серой, азотом, углем. С водородом алюминий непосредственно не взаимодействует, гидрид его получают косвенным путем:
AlCl3 + 3 Li Н  AlH3 + 3LiCl
AlH3 + 3LiCl
После удаления оксидной пленки алюминий энергично соединяется с водой: 2А1 + 6Н20 = 2Al /0H/3 + 3H2
Будучи амфотерным, алюминий растворяется в растворах кислот и щелочей, образуя соответстдующие катионные и анионные комплексы
2AI + 6HCl + 12H2O = 2 [Al /H2O/6 ]Cl3 + 2H2
2AI + 6H + 12H2O = 2 [Al /H2O/6 ] +3 + 3H2
2AI + 6NaOH + 6Н2O = 2Na3 [Al /OH/6 ] + 3H2
2AI + 6OH - + 6Н2O = 2 [Al /OH/6 ] -3 + 3H2
Алюминий практически не взаимодействует с концентрированными и сильно разбавленными азотной и серной кислотами. В умеренно концентрированных растворах этих кислот он растворяется.
С НN03 реагирует с выделением / N2;NO2;NO;NH3 / :
8AI + 3ОНNO3 = 8AI /NH3/3 + 3N2O5 + 15H2O
Алюминий - комплексообразователь Na3 [Al/OH/6 ] , характерные к.ч. = 6;4.
Вопрос: Какими свойствами обладают соединения алюминия?
Ответ: Химическая связь в соединениях алюминия преимущественно ковалентная, но с более выраженной ионностью в сравнении с соединениями бора.
А1/0Н/3 - студенистый белый осадок, получают действием щелочей на растворы солей алюминия.
А1С13 + 3NaOH = А1/ОН/3 + 3NaCI
А13+ + 3ОН - = А1/ОН/3
Диссоциацию амфотерного А1/ОН/3 можно выразить уравнением:
А13+ + 3ОН -  А1/0Н/3
А1/0Н/3  H3AlO3
H3AlO3  HAlO2 + H2O
HAlO2 + H2O H+ +AlO2- + А13+ +3ОН -
H+ +AlO2- + А13+ +3ОН -  А1/0Н/3
А1/0Н/3  А1/0Н/3 +3H2O
А1/0Н/3 +3H2O [Al /OH/4 /H2O/2] - + H+
[Al /OH/4 /H2O/2] - + H+
 [Al /OH/6 ] -3 + 3H+
[Al /OH/6 ] -3 + 3H+
по типу кислоты
Гидроксид алюминия в Н2О и растворе NH3 не растворим, но свежеприготовленный легко растворяется в кислотах и щелочах с образо-ванием солей.
А1/0Н/3 + 3HCI = А1С13 + 3Н20
А1/0Н/3 + 3H+ = А13+ + 3Н20
или
А1/0Н/3 + 3HCI + 3Н20 = [Al /H2O/6 ]Cl3
А1/0Н/3 + 3H+ + 3Н20 = [Al /H2O/6 ] +3
сплавлен. Na[А1/0Н/4] или Na3[А1/0Н/6]
А1/0Н/3 + NaOH 
в ра-ре
NaА1О2 + 2Н20
сплавл.
А1/0Н/3 +OH -  А1О2 - + 2Н20
А1О2 - + 2Н20
в ра-ре [А1/ОН/4] - или [А1/ОН/6] -3
[А1/ОН/4] - или [А1/ОН/6] -3
При растворении A1/OH/3 в щелочах полученные соли называют алюминатами.
А12Оз - белое тугоплавкое с высокой твердостью вещество, относится к амфотерным оксидам, с водой и кислотами не взаимодействует, со щелочами только при нагревании
сплавление
А12Оз + 2NaOH  2NaА1О2 + Н20
2NaА1О2 + Н20
сплавление
А12Оз + Na2СО3  2NaА1О2 + СО2
2NaА1О2 + СО2
сплавление
А12Оз + 6KHSO4  2K2SO4 + 3Н20 + А12 /SO4/3
2K2SO4 + 3Н20 + А12 /SO4/3
Известно много солей алюминия. В растворе как соли катиона A1+3 /A1C13, Al / NO3 /3 , А12 /SO4/3 ,так и алюминаты подвергаются гидролизу:
I ступень A1C13 + Н20 = AlOHCl2 + HCl
гидролиза A1+3 + HOH = AlOH +2 + H+ / pH< 7/
Соли алюминия, образованные очень слабыми летучими кислотами Н2S,H2SO3, Н2СО3 и т.д./, гидролизуются полностью:
А12S3 + 6Н20 = 2A1/OH/3 + ЗН2S
Вопрос: Является ли алюминий биогенным элементом?
Ответ: Алюминий микробиогенный элемент, обнаружен во всех органах, тканях человека, больше всего его содрежится в легких, печени, костях, головном мозгу, почках. С возрастом A1 накапливается в крови /в цельной крови от 0,02 - 0,06 мг на 100 мл крови/. В организме человека и животных A1 содержится в основном в связанном с белками виде. Основная биологическая роль алюминия заключается в участии в построении эпителиальной и соединительной ткани, в процессах регенерации костной ткани, в обмене фосфора. Возбуждение ЦНС сопровождается повышением A1в крови, а торможение — понижением.
Вопрос: Какие соединения алюминия применяются в медицине? Ответ: Из соединений алюминия в медицине применяют: A1ОН/СН3СОО/2 - бурова жидкость оказывает вяжущее и противовоспалительное действие при заболеваниях кожи и слизистых оболочек /примочки/ компрессы/.
A1/OH/3 — гидроксид A1 - обволокивающее, адсорбирующее средство. Применяется внутрь при язве желудка и 12-перстной кишки, при отравлениях, как наружное в присыпках.
Силикат алюминия используется в составе белковой глины в виде присыпок, мазей.
Алюминиевые квасцы КA1/SO4 /2 • 12H2О - обладают вяжущим, дезинфицирующим и кровоостанавливающим действием. Они употребляются в виде водных растворов при катарах слизистых оболочек, при лечении ран, язв, мокнущих поверхностей.
Сульфат алюминия А12 /SO4/3 • 18H2О используется для очиски водопроводной воды. В результате гидролиза соли получается коллоидный раствор А1/OH/3, студенистый осадок, который и захватывает в воде частицы и бактерии, не пропуская их через фильтр.
Вопрос: Каково строение внешнего электронного уровня в нормальном и возбужденном состоянии атомов р-элементов IV-А группы и чему равны их степени окисления?
Ответ: Строение внешнего электронного уровня в нормальном и возбужденном состоянии атомов р-элементов IV-А группы и характерные СО представлены в табл.23.
Таблица 23
| Группа IV-А Элемент | Распределение электронов на внешних орбиталях | CО | Валент- ность | ||||
| Нормальное состояние | Возбужденное состояние | ||||||
| С |     — —      | +2, +4, -4 | II , IV | ||||
| Si,Ge,Sn,Pb |          - - - - -
S P d S P d - - - - -
S P d S P d
| +2, +4, -4 | II , IV | ||||
| Изменение свойств простых веществ | твердые вещества
  С,Si Ge,Sn Pb
неметаллы металлы с амфотерными типичный металл
свойствами
С,Si Ge,Sn Pb
неметаллы металлы с амфотерными типичный металл
свойствами
 возрастание металлических свойств
возрастание металлических свойств
| ||||||
Для р-элементов IV- А группы характерны две степени окисления
+ 2 и +4. Первая отвечает восстановительным свойствам, вторая -окислительным.
Вопрос: Как изменяются КО свойства соединений р-элементов IV-А группы?
Ответ: Таблица 24
Изменение КО свойств соединений Р-элементов IV-А группы.
| co | Изменение КО свойств соединений р-элементов IV-А группы. |
| +2 +4 | СО - несолеобразующий оксид, не взаимодействующий при комн. ни с кислотами, ни с щелочами.
Si - неустойчивое соединение,образующееся с большим трудом
GeO,SnO,PbO-амфотерные оксиды с преобладанием основных свойств
Ge/OH/2, Sn/OH/2, Pb/OH/2 - амфотерные соединения-гидроксиды
 усиление основных свойств
Характерна для C и Si / так как rэ+4 < rэ+2 , то связь Э+4 -О прочнее связи Э+2 -О, соединения Э+4 -ОН проявляют кислотные свойства/
CO2,SiO2 -кислотные оксиды
Ge2O, SnO2, PbO2 -амфотерны,с преобладанием кислотных свойств
H2CO3, H2SiO3, H2GeO3, H2SnO3, H4PbO4 - слабые кислоты
усиление основных свойств
Характерна для C и Si / так как rэ+4 < rэ+2 , то связь Э+4 -О прочнее связи Э+2 -О, соединения Э+4 -ОН проявляют кислотные свойства/
CO2,SiO2 -кислотные оксиды
Ge2O, SnO2, PbO2 -амфотерны,с преобладанием кислотных свойств
H2CO3, H2SiO3, H2GeO3, H2SnO3, H4PbO4 - слабые кислоты
 сила кислот уменьшается
сила кислот уменьшается
|
Вопрос: Дайте характеристику водородным соединениям элементов IV-А группы.
Ответ: Для всех p—элементов IV-А группы свойственно образование водородных соединений. Однако устойчивость их в подгруппе резко падает. Так, если углерод образует необозримое число водородных соединений, то для кремния их известно сравнительно немного, для германия их несколько, для олова - два, а для Pb удалось получить только одно крайне неустойчивое соединение - PbН4.
Вопрос: Охарактеризуйте способность р-элементов IV-А группы
к комплексообразованию.
Ответ: Углерод /IV/ не проявляет свойств акцептора, т.к. не
имеет свободных орбиталей на внешнем уровне. Молекулы СО и ионы СN -, содержащие углерод, могут выступать в качестве лигандов в различных комплексах, например, K4[Fе/СN/6]. У аналогов углерода есть свободные d-орбитали, поэтому они в четырехвалентном состоянии легко образуют многочисленные комплексные соединения, проявляя свойства акцепторов. Чаще всего координационное число У Si /IV/, Gе /IV/ равно 6;
H2[SiF6], H2[GeF6], Na2[Sn/OH/6]4 и т.п. Свинец образует комплексные соединения с координационным числом 4 - K2[PbI4] и др.
Вопрос: Дайте характеристику физико-химических свойств углерода и его важнейших соединений. Применение их в медидине.
Ответ: Известно несколько аллотропных модификаций углерода -
алмаз, графит и карбин. Огромная разница в их свойствах объясняется особенностями их молекулярного строения.
Любой кристалл алмаза, даже огромный, шестисотграммовый "Куллинан" - это по существу одна молекула в высшей степени регулярного, почти идеально достроенного трехмерного полимера. В графите полимерная упорядоченность распространяется только в двух направлениях - по плоскости, а не в пространстве.
Синтетическим путем советскими химиками был получен линейный полимер углерода - карбин, впоследствии найденный в метеоритном кратере.
Углеродные атомы в карбине соединены в цепочку чередующимися одинарными и тройными связями / — С С— С
С— С С —/. Внешне он выглядит как черный мелкокристаллический порошок, обладает полупроводниковыми свойствами. Открылись у карбина и вовсе неожиданные свойства. Оказалось, что кровь при контакте с ним не образует сгустков — тромбов, поэтому волокно с покрытием из карбина стали применять при изготовлении неотторгаемых кровеносных сосудов. В атмосфере углерод находится в виде диоксида - CO2, и хотя содержание СО2 в атмоофере невелико /0,03%/,
С —/. Внешне он выглядит как черный мелкокристаллический порошок, обладает полупроводниковыми свойствами. Открылись у карбина и вовсе неожиданные свойства. Оказалось, что кровь при контакте с ним не образует сгустков — тромбов, поэтому волокно с покрытием из карбина стали применять при изготовлении неотторгаемых кровеносных сосудов. В атмосфере углерод находится в виде диоксида - CO2, и хотя содержание СО2 в атмоофере невелико /0,03%/,
его общая масса составляет около 600 млн.т. Углерод входит в
состав тканей всех живых организмов. Содержание углерода в организме человека - 10,5%, в земной коре - 0,08 ат.%
Углерод в виде активированного угля применяется в виде порошка и таблеток внутрь при жедудочно-кишечных заболеваниях, метеоризме, при отравлениях алколоидами, животными ядами, солями тяжелых металлов, бактерийными токсинами и т.д.
Углерод образует с кислородом два соединения СО и СО2. Оксид углерода /II/ образуется в процессе горения угля:
С + СО2  2СО
2СО
Это газ без цвета и запаха. Очень токсичен, т.к., соединяясь с гемоглобином, образует карбоксигемоглобин,что препятствует переносу кислорода кровью. Так как константа равновесия реакции образования карбоксигемоглобина примерно в 300 раз выше, чем оксигемоглобина, то небольшие примеси СО в воздухе вызывают— тяжелые отравления При отравлениях СО рекомендуется вдыхание чистого воздуха, согревание тела, искусственное дыхание. Предельно допустимая концентрация окиси углерода в воздухе 0,02мг/л.Оксид углерода при комнатной температуре мало реак-ционноспособен, но при нагревании вступает в реакции со многими веществами.
+H2O  HCOOH -муравьиная кислота
HCOOH -муравьиная кислота
+NaOH  HCOONa - фомиат натрия
HCOONa - фомиат натрия
CO +H2  CH2n , CH3OH и др.
CH2n , CH3OH и др.
+Cl2  COCl2 фосген /ядовитый газ/
COCl2 фосген /ядовитый газ/
+O2  CO2
CO2
Диоксид углерода СО2- продукт полного сгорания углерода. При нормальных условиях он тяжелее воздуха, при повышенном давлении легко сжимается и может быть получен в твердом виде /"сухой лед"/.
СО2 применяют для тушения огня, т.к. этот оксид препятствует горению. Однако щелочные и щелочноземельные металлы легко сгорают в СО2
2 Mg + СО2  2 MgO + C
2 MgO + C
Растворение СО в воде приводит к частичному образованию слабой и непрочной угольной кислоты:
СО2+ Н2О  H2CО3 — равновесие смещено влево.
H2CО3 — равновесие смещено влево.
Солм угольной кислоты — карбонаты обычно мало растворимы в воде. Хорошо растворимы карбонаты Na, К, Rb, Cs и аммония. При нагревании карбонаты разлагаются:
t
СаСO3  СаО + СО2
СаО + СО2
Чем сильнее выражены металлические свойства элемента, тем более устойчив карбонат. Для щелочных металлов известны гидрокарбонаты. При слабом нагревании они легко разлагаются:
2NaHCО3  Na2CО3 + СО2 + Н2О
Na2CО3 + СО2 + Н2О
Оксид углерода /IV/ участвует в фотосинтезе углеводов. Растительный пигмент хлорофилл поглощает энергию солнечного света,которая используется для превращения углекислого газа и воды в углеводы и кислород.
Общая схема процесса фотосинтеза
hv
х СО2 + у Н2О  Сх / Н2О /у + хО2
Сх / Н2О /у + хО2
хлорофилл
Углеводы являются огромным хранилещем энергии и существование всех форм жизни на нашей планете обязано фотосинтезу.
Именно фотосинтез сделал доступным кислород для существовавших живых форм. В свою очередь присутствие кислорода привело к
созданию аэробного метаболизма.
Суммарная реакция клеточного дыхания
в аэробных условиях:
6СО2 + глюкоза + 38/АДФ + H3PO4/  6СО2+ 6Н2О + 38 АТФ
6СО2+ 6Н2О + 38 АТФ
СО2, образующийся в процессе клеточного дыхания, переносится кровью и легким в виде растворенного газа в жидкости, в виде бикарбонатов и в комплексе с гемоглобином /карбгемоглобин/.
Оксид углерода /IV/ находит применение в медицине в составе дыхательных смесей с кислородом.
Цианистоводородная кислота, НСN, содержащая углерод, является ядом, взаимодействует с дыхательным ферментом, соединяясь с Fе+3, с которым она образует прочные комплексы. В результате тканевое дыхание останавливается. Клетки мозга, управляющие дыханием, исключительно чувствительны к этому эффекту. Смерть наступает мгновенно в результате паралича этого нервного центра.
Вопрос: Дайте характеристику физико-химическим свойствам Si и его важнейших соединений. Применение в медицине соединений кремния.
Ответ: Ближайшим аналогом углерода по числу валентных электронов является кремний. Однако кремний, в отличие от углерода, имеет свободные р-,d- орбитали. Разница в строении атомов делает существенном различие и в химических свойствах. Так, углерод -основной элемент в органической химии, кремний - в неорганической. После кислорода кремний занимает второе место по распространению в земной коре. Главная масса земной коры состоит из силикатных пород. Конечный продукт так называемого "выветривания" горных пород — обычный кварцевый песок. -SiO2.
Существует мнение о билогической инертности кремния. С другой стороны, известно, что при высоком содержании пыли оксида кремния /IV/ в воздухе она попадает в легкие человека и вызывает серьезное заболевание- силикоз /у бурильщиков кварцевых пород, точильщиков, горняков/. При силикозе кремниевая кислота вызывает глубокие изменения в процессах обмена веществ, нарушает физиологические функции организма и морфологическую структуру органов и тканей. Некоторые кремнийорганические соединения - арилсилотроны оказались токсичными для всех теплокровных животных. В то же время в человеческом организме кремний есть практически повсеместно.
В среднем организм человека содержит п .I0 -3%Si . Наибольшим со-
держанием кремния отличаются лимфоузлы корней легких, хрусталик глаза, гладкие мышцы кишечника и желудка, поджулудочная железа. Количество Si в коже новорожденных — максимально, а с возрастом оно уменьшается. Содержание в легких человека за время его жизни
возрастает 140 - 20000 мкг SiO2 на 1 г сухой ткани, а в лимфоузлах корней легких - с 270 до 50000 мкг SiO2 на 1 г сухой ткани.
В организме человека Si присутствует в 3-х формах.
1/. Растворимые в Н2О неорганические соединения, которые проникают через стенки клеток и могут легко выводится из организма/орто-кремниевая кислота, ионы орто- и олигокремниевай кислот/.
2/. Растворимые в органических растворителях кремнийорганические и комплексные соединения /орте— и олигокремниевые эфиры углеводов, белков, холестерина и других стеринов/.
3/. Нерастворимые нолимеры Si /поликремниевая кислота, амфорный кремнезем, нерастворимые силикаты и кварц./
Si в организме человека играет важную роль. Соединения Si облегчают удаление с мочой метаболитов, чужеродных и токсических веществ, служат барьером, задерживающим развитие дегенеративных процессов, активируют обмен коллагена.
Обмен Si тесно связан с обменом Са. Старение организма сопряжено с нарушением равновесия Si - Са: снижение содержания Si и повышение содержания Са в соединительной ткани. Обмен Si также связан с обменом Р, Cl, F, K, Na, Al, Mо и Со.
Человеку ежедневно требуется 20-30 мг SiO2, который поступает с Н2О и пищей.
Понижение поступления Si в организм приводит к "силикозной" анемии, наблюдаемой при рахите, заболеваниях лимфосистемы и др. Повышенное поступление Si в организм наблюдается в кремниевых биогеохимических провинциях /в местах выхода кремниевых пород/. Это приводит к нарушениям фосфориокальциевого обмена, образованию камней в мочевых путях.
Вот почему исследование роли кремния в живых организмах и изыскания возможности использования этого элемента для лечения и профилактики различных заболеваний и травм, а также для борьбы со старением, чрезвычайно актуально.
Элементарный кремний при обычной температуре химически не активен, но щелочи переводят кремний в соответствующие соли кремниевой кислоты:
ки-та
------x------->
Si | +2KOH + Н2О
 K2SiO3 + 2Н2
K2SiO3 + 2Н2
Кремниевые соли — силикаты, как правило, бесцветны, тугоплавки и практически нерастворимы в воде за исключением силикатов натрия и калия.
Наиболее характерным и усточивым соединенней кремния является его оксид /IV/ SiO2. Все свойства диоксида кремния свидетельствуют о большой прочности кристаллических решеток кварца. В природе встречается кварц с самой различной окраской: с великолепной фиолетовой или голубовато-фиолетовой окраской кристаллы называют аметистом, с желтой -цитрином, с дымчатой -топазом. К разновидностям кварца относят агат, яшму, опал, кремень. Оксид кремния /IV/ химически инертен, нерастворим в воде и кислотах. Реагирует только с плавиковой кислотой:
SiO2+ 4HF  SiF4 + 2Н2О
SiF4 + 2Н2О
Оксид кремния /IV/ соответствует слабым нерастворимым в воде кремниевым кислотам nSiO2 • mН2О, в свободном виде выделены орто-кремниевая H4SiO4, метакремниевая H2SiO3 и др. кислоты. При сплавлении со щелочами или карбонатами щелочных металлов образуются соли кремниевых кислот - силикаты:
SiO2 + 2NaОН  Na 2SiO3 + Н2О
Na 2SiO3 + Н2О
Кремниевая кислота и силикаты - нежелательная примесь в питьевых водах, благодаря внешнему сходству со стеклом и растворимости в воде, силикаты натрия и калия называют "растворимым стеклом". При действии соляной или серной кислоты на раствор Na 2SiO3 образуется практически нерастворимый в воде гель кремниевой кислоты H2SiO3. Отмытый и высушенный гель кремниевой кислоты называется силика— гелем. Природные силикаты являются обычно полисиликатами или алюмосиликатами, образующимися из кислот с общей формулой хН2О • yAl2O3 • 2SiO2. Исходными основными веществами для получения стекла являются сода Nа2СO3, известняк СаСО3, песок SiO2.Смесь этих веществ нагревают в печах до 1400° и выдерживают до полного удаления газов, получая
Nа2СO3 + СаСО3 + 6SiO  Na2O.Ca.O.6SiO2 +2CO2
Na2O.Ca.O.6SiO2 +2CO2
стекло, предназначенное для приготовления широчайшего ассортимента бытовых изделий. В качестве стеклообразующих веществ используются разнообразные оксиды. Для получения цветных стекол к ним прибавляют в процессе варки оксид меди /синий цвет/, оксид хрома /зеленый цвет/ и т.д. Стекла молочного цвета содержат фториды. При плавлении в кислородно-водородном пламени кварц превращается в кварцевое стекло, которое, в отличие от обычного стекла, пропускает ультрафиолетовые лучи и используется в ртутных лампах, применяемых для облучения больных ультрафиолетовыми лучами. Кварцевое стекло выдержит резкую смену температуры, устойчиво к действию кислот /кроме плавиковой/ и находит широкое применение для изготовления лабораторной посуды и в химической промышленности.
Кварц и каолин /А12О3 . 2SiO2 . 2H2O / составляют основу глины. Особо чистый сорт глины, белая глина, применяется внутрь как адсорбирующее средство при гастритах и кишечных заболеваниях. В семоси с другими веществами применяется наружно при ожогах, экзе-мах и язвах.
Кремниевые соединения /силиконы/ получили широкое применение в
медицине для приготовления искусственных клапанов сердца, искус— стенного сердца и т.п.
Вопрос: Каково строение внешнего электронного уровня атомов эле— центов V-А группы в нормальном и возбужденном состоянии и соответветствующие СО.
Ответ: Таблица 2 5
Строение внешнего электронного уровня атомов элементов V-А группы в нормальном и возбужденном состоянии и соответствующие СО.
| Элемент | Распределение электронов на внешних орбиталях | CО | |||
| Нормальное состояние | Возбужденное состояние | ||||
| N |            | -3, +1, +2, +3, +4, +5 | |||
| P , As, Sb , Bi |     - - - - - - - - - - 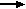       S P d S P d
S P d S P d
| -3, +3, +5 | |||
| Изменение свойств простых веществ | газ твердые вещества
—— ————————————
N P As Sb Bi
————————
неметаллы
 усиление металлических свойств
усиление металлических свойств
| ||||
Вопрос: Почему максимальная валентность азота в соединениях равна 4?
Ответ: Из таблицы 25 легко увидеть, что валентность 5 азот прояв-лить не может, т.к. имеет только три неспаренных электрона и отсутствует d-орбиталь. Для осуществления состояния атома азота с 5 неспаренными электронами необходимо возбудить и распарить S-электронами, переведя на 3-й энергетический уровень, что потребует большой затраты энергии. Поэтому азот, в отличие от других элементов группы, не является пятивалентным. Соединения азота со степенью окисления +5 / N2O5 ; HNO3/ можно рассматривать как производное четырехвалентного иона N+, который имеет во внешнем электронном слое 4 неспаренных электрона:
N  S
S  P
P 


Так, в молекуле азотной кислоты / Sp2 -гибридиpацbя/ одна из связей одинарная, две другие близки к двойным.
O
H ——— O——— N 

O
Вопрос: Как изменяются КО и ОВ свойства оксидов и гидроксидов
р-элементов V-А группы?
Ответ: Таблица 26
| CO | Изменение КО и ОВ свойств оксидов и гидроксидов р-элементов V-А группы |
| +3 | N2O3 P2O3 As2O3 Sb2O3 Bi2O3
кислотные оксиды амфотерные соединения основной оксид
HNO2 H3PO3 H3AsO3 Sb/OH/3 Bi/OH/3
кислоты амфотерные гидроксиды гидроксид основного
характера
 усиление основных свойств
ОВ ослабление восстановительных свойств
двойственность
усиление основных свойств
ОВ ослабление восстановительных свойств
двойственность 
|
| +5 | N2O5 P2O5 As2O5 Sb2O5 Bi2O5
кислотные оксиды
HNO3 H3PO4 H3AsO4 H3SbO4 КBiO3
кислоты
 уменьшение кислотных свойств
окислительные свойства усиливаются
уменьшение кислотных свойств
окислительные свойства усиливаются

|
Азот, в отличие от остальных элементов группы, образует с кислородом пять оксидов, проявляя СО от +1 до +5.
Вопрос: Охарактеризуйте физико-химические свойства азота и его
важнейших соединений. Применение их в медицине.
Ответ: Азат входит в состав белков и других органических соединений,селитр /например, чилийской NaNO3/. В свободном состоянии содержится в атмосфере /75,5%/. Энергия связи N N
N
велика /942 кдж/моль /, поэтому в молекулярном состоянии азот очень инертен. Чтобы азот стал более реакционноспособным, его надо перевести в атомарное состояние. Это достигается при помощи катализаторов, температуры, воздействии электрозаряда. При -198°С азот превращается в бесцветную жидкость, употребляющуюся обычно при химических,биологических и медицинских работах для охлаждения и замораживания. Физиологически при обычных условиях азот инертен. При повышенном давлении, например, при погружении водолазов, растет концентрация растворенного азота в крови и тканях организма. Это приводит к так называемому азотному наркозу. Водолаз словно пьянеет: нарушается координация движений, сознание. Симптомы наркоза отсутствуют, если в скафандр вместо обычного воздуха подается гелио—кислородная смесь.
Азот — элемент, который относится к типичным неметеллам, его
связи всегда ковалентны. В соединениях азота встречаются все степени
окисления от -3 до +5:
N -3H3 ; N2-2H4 ; N-1H2 ; N20 ; N2+1O; N+2O; HN+3O2 ; N+4O2 ; HN5O3
При обычной температуре он взаимодействует только с металлом литием, образуя Li3N. Однако при нагревании он начинает реагировать со многими металлами, образуя нитриды: Mg3N2; Ва3N2; AIN и др.
NН3 - очень ядовит и действует на слизистые оболочки глаз и дыхательных путей. Вдыхание большого количества может привести к воспалению легких.
Нашатырный спирт широко применяется в медицине как средство для возбуждения дыхательного центра /первая помощь при угаре, обморочном состоянии, опьянении/. Раствор аммиака оказывает антимикробное действие и хорошо очищает кожу.
Аммиак используется для получения солей аммония:
+HNO3
 NH4NO3
NH4NO3
NH3  |
|
 NH4Cl
NH4Cl
+HCl
NH4Cl /нашатырь/ применяется внутрь при отеках сердечного происхождений, а также как отхаркивающее при бронхитах, пневмонии и т.д.При замещении водорода на электроотрицательные группировки или органические радикалы образуются амины и имины. Например, гидроксиламия NH2ОН , метилаяин СН3NH2 , анилин С6Н5NH2 , а также аминокислоты:
CH3 CH3 CH3
| | |
NН3 + C=O  C=NН
C=NН  C—NН2
C—NН2
| -H2O | |
СООН СООН СООН /аланин/
ПВК
Для химии живых организмов очень большое значение имеют α-аминокислоты, где карбоксильная группа и аминогруппа находятся у одного ж того же атома углерода / α-атом/.
Аминокислоты являются амфотерными и могут взаимодействовать как с кислотами, так и с основаниями:
+HCl R-CH-NH3 + Cl-
 |
|
R - CH - COOH COOH
|  |
|
NH2 +NaOH R-CH-COO- Na+
|
NH2
Оксид азота / I / N2O- бесцветный газ, химически мало активен. Малые концентрации его вызывают чувства опьянения и потерю болевых ощущений, поэтому применяется в медицине в смеси с кислородом для наркоза при операциях, при профилактике травматического шока, острой коронарной недостаточности и для обезболевания родов.
Оксид азота /II/ NO - бесцветный, очень ядовитый газ, быстро окисляющийся кислородом воздуха в красновато-коричневый NO2 /IV/
2NO + O2  2 NO2
2 NO2

восстановитель
При действии некоторых восстановителей проявляет окислительные свойства:
2NO + SO2  SO3 + N2O
SO3 + N2O

окислитель
Оксид азота /III/ N2O3- темно-синяя жидкость, при низких температурах разлагается:
N2O3  NO + NO2
NO + NO2
С водой образует азотистую кислоту, а с основаниями-нитриты:
+ Н2О
 2HNO2
2HNO2
N2O3 - | +OH
 2NaNO2 + Н2О
2NaNO2 + Н2О
NO2 - токсичен, энергично реагирует с металлами. Применяется как сосудорасширяющее средство, при отравлении цианидами. Оксид /V/ N2O5 - белые кристаллы, неустойчив, постепенно разлагается, сильный окислитель. Оксиды азота - опаснейшие промышленные яды. При хроническом отравлении ими наблюдается повышенное сердцебиение, кровохаркание, катар дыхательных путей и разрушение зубов. Максимально допустиная концентрация оксидов азота в воздухе 0,005 мг/м3.
Азотистая кислота /HNO2/ - кислота средней силы. Известна только в разбавленном водном растворе и в газовой среде:
NO /г/ + NO2 /г/ + Н2О /г/  2HNO2 /г/
2HNO2 /г/
Азотистая кислота, в которой азот имеет промежуточную степень окисления +3, может быть как окислителем, так и восстановителем. Сильные окислители переводят NO2 - в NO3 - :
5NaNO2 + 2 KMnO4 + 3Н2SO4  5NaNO3 + 2MnSO4 + K2SO4 + 3Н2О
5NaNO3 + 2MnSO4 + K2SO4 + 3Н2О
Сильные восстановители обычно восстанавливают HNO2 до NО:
2NaNO2 + 2KI + 2Н2SO4  Na2SO4 + 2NО + K2SO4 + I2 + 2Н2О
Na2SO4 + 2NО + K2SO4 + I2 + 2Н2О
Соли азотистой кислоты — нитриты — можно получить восстановлением нитратов, например:
NaNO3 + Pb  PbO + NaNO2
PbO + NaNO2
Нитриты устойчивее HNO2. Нитриты,так же как 2HNO2, обладают окислительной и восстановительной активностью.
Азотная кислота - сильная одноосновная кислота и сильный окислитель. Концентрированная азотная кислота при нормальной температуре разлагается:
4HNO3  4NO2 + 2Н2О + O2
4NO2 + 2Н2О + O2
Вследствие этого высококонцентрированная HNO3 имеет обычно бурую окраску. Пары ее сильно ядовиты. Попадание HNO3 на кожу приводит к тяжелым ожогам. Концентрированная и разбавленная HNO3 ведет себя различным образом:
|cлабые вост. / С, S, Р, Сu, Ag, Нg /
_________________________________________________
HNO3 разб. ____ |акт. вост. /Са, Mg, А1,NН4 , NO3/
__________________________________________________
|вост. ср.силы /Zn, NO, N2O, NН4 , NO3, N2 /
__________________________________________________
Al, Cr, Fe пассивация

HNO3 конц. ------ | вост.
 NO2
NO2
Соли азотной кислоты - нитраты - получают действием HNO3 на металлы, оксиды, гидррксиды или карбонаты. Все нитраты хорошо растворимы в воде.
Азотная кислота HNO3 применяется наружно для прижигания и выведении бородавок и мозолей. Нитриты вызывают значительное пониже- ние артериального давления, особенно при гипертонии. Однако, для лечения гипертонической болезни, они не применяются, т.к. гипотензивный эффект сопровождается побочными явлениями, непостоянен и непродолжителен. Иногда нитриты применяются при стенокардии, т.к. они быстро вызывают расширение сосудов и курируют болевой синдром. Органические нитриты /нитроглицерин, эринит и др./ широко применяются при коронарной недостаточности.
Вопрос: Назовите важнейшие соединения фосфора. Охарактеризуйте их физико-химические свойства.
Ответ: Фосфор - аналог азота. Хотя физические и химические свойства этих элементов очень сильно различаются, есть у них и общее, в частности то,что оба эти элемента необходимы животным и растениям.
Фосфор - неметалл средней активности. Для фосфора характерно II аллотропных модификаций, наиболее изучены белый, красный, черный. Белый фосфор крайне ядовит /доза - 0,1-0,15 г. смертельна для человека/. При отравлении фосфором необходимо принимать во внутрь 2% раствор медного купороса через каждые пять минут до появления рвоты.
При нагревании-без доступа воздуха выше 250°С белый фосфор превращается в красный. Это уже полимер, но неупорядоченной структуры. Реакционная способность у красного фосфора значительно меньше, чем у белого. Он не светится в темноте, не растворяется в сероуглероде, не ядовит.
Другая, еще более высокомолекулярная модификация фосфора - ченый фосфор, получен в условиях болыших давлений /200 тыс. атм., t° -200°С/ и скорее напоминает графит, чем белый или красный фосфор. Это мало активная форма.
Фосфор не реагирует с водородом. Фосфористый водород /фосфин/ получают гидролизом фосфида кальция:
Са3Р2 + 6Н2О  3Са/ОН/2 + 2РН3
3Са/ОН/2 + 2РН3
или нагреванием белого Р с концентрированным раствором щелочи. При этом происходит реакция диспропорционирования:
Р4+ 3NaOH + 3Н2О  РН3 + 3NaН2PO2
РН3 + 3NaН2PO2
гипофосфит натрия
Фосфин - РН3 - сильно ядовитый бесцветный газ с чесночным запахом. С сильными кислотами РН3 образует соли фосфония. В воде они полностью гидролизуются. Фосфин - энергичный восстановитель, при действии на него галогенов образуются три- и пентагалогениды:
РН3 + 3Сl2  PCl3 + 3HCl
PCl3 + 3HCl
РН3 + 4Сl2  PCl5 + 3HCl
PCl5 + 3HCl
Фосфор активно взаимодействует с галогенами. При избытке фосфора образуется РНаI3, при изоытке галогенов - РНаI5.
РНаI3 и РНаI5 являются ангидридами соответствующих кислот.
PCl3 + 3Н2О  Н3РО3 + 3HCl
Н3РО3 + 3HCl
РС15 + 4Н2О  Н3РО4 + 5HCl
Н3РО4 + 5HCl
РС15 + Н2О  РОС13 + 2HCl
РОС13 + 2HCl
РС15 и РОС13 легко отщепляют хлор и поэтому являются удобными хлорирующим агентами. Указанные вещества обладают удушливым запахом и ядовиты.
Кислородсодержсшие соединения Фосфора.
/P2O3 /x , /P2O5 /x , /P2O4 /x Оксид P2O3 состоит из димерных молекул P4O6 , получается при сжигании фосфора…Контрольные вопросы.
1.Какие элементы ПСЭ относятся к р-блоку?
2.Как изменяются наиболее характерные свойства /Rа; R; OЭO; СO; I; неметаллические свойства/ в III-А—VII-А группах?
3. Охарактеризуйте комплексообразующую способность р-элементов.
4. Как изменяются КО и ОВ свойства соединений:
а/ III—А группы, б/ IV-А группы, в/ V-А группы, г/ VI-А группы,
д/ VII-А группы?
5. Каковы валентные возможности и СО элементов:
а/ III-А группы, б/ IV-А группы, в/ V-А группы, г/ VI-А группы?
6. Чем р-элементы II периода отличаются от р-элементов тех же
групп других периодов?
7. Чему равна валентность азота в солях аммония и азотной кислоте?
8. Почему фтор во всех соединениях имеет степень окисления -1, а хлор проявляет переменную степень окисления от -1 до +7 ?
9. Составьте формулы хлоридов элементов III периода и разделите на кислотные, основные к амфотерные.
10. Какие хлориды NACl; SiCl4; PCl5 - - будут взаимодействовать между собой?
11.Как взаимодействуют р-элементы с водородом?
12.Составьте уравнения гидролиза бинарных соединений р-элементов РС13; ICl; Cl3N и P2S3 , если электроотрицательность элементов в ряду Р, I ,S, С1,N возрастает слева направо?
13.Как изменяется сила кислот водородных соединений р-элементов и их устойчивость в ряду Н3Аs - Н2Se - НВr, сравните степень гидролиза солей этих кислот К3As , К2Se, ХВr ? Составьте уравнения реакций гидролиза.
14. Как изменяются восстановительне свойства водородных соединений р-элементов в следующих рядах:
NН3, Н2О, HF
Н2О, H2S, Н2Se, Н2Tе
15.В какой последовательности изменяется прочность водородной
связи между молекулами водородных соединений р-элементов в
ряду H2S, HCl, NН3, Н2О, НF , если электроотрицательность
элементов в ряду S-Cl-N-O-F возрастает слева направо.
16. Докажите с помощью реакций амфотерность Al.
17. Где и как применяются в медицине бypa, борная кислота и соединения Al /белая глина, гидроксид Al, квасцы, ацетат А1/.
18. Какие соединения углерода обладают токсичными свойствами?
19. Какова биогенная роль С оn vivo?
20. Какие соединения р-элементов IV-А группы применяются в медицине?
21. Где применяются в медицине соединения р-элементов V—А группы и какие из них являются токсичными?
22- Какие элементы VI-А группы и их соединения применяются в медицине?
23. Напишите продукты реакции, составьте электронные схемы для следующих реакций и подоврите коэффициенты:
NaBr + H2SO4 
H2S + K2Cr2O7 + H2SO4 
H2SO3 + Br2 +H2O 
SO2 + HI 
KI + KNO2 + H2SO4 
KMnO4 + KNO2 + H2SO4 
24. Какие соединения галогенов применяют в медицине?
25. Какова биогенная роль галогенов?
26. Как изменяется жесткость оснований Льюиса в ряду F -, С1 -, Вr -, I -. Дать объяснение с позиций концепции ЖМКО.
27. Как изменяется прочность связей и константа устойчивости в ряду лигандов F -, С1 -, Вr -, I - для катиона А1+3 / жесткая кислота и катиона Аg+ /мягкая кислота/.
28. С какими электронодонорными /О,N,S/ биолигандов катионы
Са+2 и Сu+3 образуют прочные связи?
Темы реферативных докладов по теме "биогенные элементы" для студентов I курса
1. Водород и его соединения. Их роль в медицине.
2. Nа и К в организме человека, соединения натрия и калия, используемые в медицине.
3.Свойства и биогенная роль Са и Мg, применение их соединений в
медицине.
4.Соединения азота, фосфора, углерода, кремния, серы, кислорода,
их биологическая роль, применение в медицине.
5.Биологическая роль d-элементов.
6. Химические основы применения соединений S, p, d-элементов в
медицине.
7. Химические основы токсического действия на организм человека
различных элементов и их соединений.
8. Концепция жестких и мягких кислот и оснований /ЖМКО/ в бионеор— ганической химии. Подбор лекарств на основе концепции /ЖМКО/ для вывода из организма различных ионов металлов.
9. Элементы в организме человека и их роль в процессе старения.
СОДЕРЖАНИЕ стр.
ПРЕДИСЛОВИЕ........................................................................3
ВВЕДЕНИЕ.......................................................................4
I. S-элеменгы и их соединения........... ......................................8
1.Содержаний темы и учебно-целевые
вопросы................................ ........................................... 8
2. Ответы на вопросы...........................................................9
3. Контрольные вопросы ............ ..................................... 33
II. d-элементи и их соединения........... ......................................34
1. Содержание темы и учебно-целевые вопросы................34
2. Ответы на вопросы..........................................................35
3. Контрольные вопросы.....................................................57
III. Р-элементы и их соединения...... ........................................59
1. Содержание темы и учебно-целевые вопросы................59
2. Отводы на вопроси.........................................................60
3. Контрольные вопросы.....................................................99
IV.Учебно—исследовательская работа
/темы докладов/............................. .....................................101
V.Литература................................... ......................................102
VI.Содержание .................................. .....................................104
– Конец работы –
Используемые теги: важ, шие, соединения, бора, алюминия, иах, Физико-химические, Свойства, КО, ОВ, Свойства, Борная, кислота, Кристаллогидрат, тетраборатанатрия, /бура0.178
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Важнейшие соединения бора, алюминия иах физико-химические свойства. КО и ОВ свойства. Борная кислота. Кристаллогидрат тетраборатанатрия /бура
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов