Результаты опыта
| № опыта | Температура опыта Т, К | Время появления помутнения t,, с | Относительная скорость реакции v yсл.=1/ t,, c-1 |
По полученным данным построить график зависимости модуля логарифма скорости реакции от обратной величины абсолютной температуры в координатах, представленных на рис. 6.2.

Рис.6.2
Сделать вывод о зависимости скорости реакции от температуры. Из графика определяют тангенс угла наклона β и вычисляют энергию активации:
Е = 2,303R • tgβ, Дж/моль
Экстраполировав полученную прямую до пересечения с осью lgх, найти отрезок, равный десятичному логарифму предэкспоненциального множителя в уравнении Аррениуса. Далее рассчитать значения констант скорости реакций для каждой температуры и на их основании – среднее значение температурного коэффициента скорости реакции.
Опыт № 3. Определение константы скорости и порядка реакции каталитического разложения пероксида водорода газометрическим методом
Пероксид водорода в водных растворах самопроизвольно разлагается согласно уравнению
2 Н2О2 = 2 Н2О + О2.
В присутствии некоторых веществ разложение заметно ускоряется. В данном опыте исследуется пример гетерогенного катализа. Разложение Н2О2 сопровождается выделением О2. Объем его, пропорциональный количеству разложившегося пероксида, измеряют с помощью прибора для определения молярной массы эквивалента металла (рис. 1.1).
Пробирку 2 наполнить 1%-ным раствором пероксида водорода Н2О2 на 2–3 см ниже пробки и поместить в термостат, установленный на 25єС. Бюретка и уравнительный сосуд должны быть заполнены водой. Через 20 мин в пробирку с пероксидом внести навеску МnО2 (около 1 мг). Размешать раствор стеклянной палочкой. Пробирку прочно присоединить к прибору. Установить воду в бюретке на уровне ее верхнего деления путем поднятия уравнительного сосуда. Включить секундомер.
Через определенные промежутки (2–5 мин) отмечать высоту жидкости в бюретке, поддерживая непрерывно одинаковый уровень воды в ней и уравнительном сосуде. Отсчитывать время при включенном секундомере. При более высокой температуре отсчеты проводить через более короткие промежутки времени. После того как реакция практически прекратится, пробирку с пероксидом поместить в стакан с водой при 80єС и выдержать в нем до полного разложения Н2О2 (уровень жидкости в бюретке перестанет изменяться). При нагревании пробирки уравнительный сосуд высоко поднять.
По окончании реакции пробирку охладить до температуры опыта, выдержать при этой температуре около 10 мин. После выравнивания уровней жидкостей в бюретке и уравнительном сосуде записать высоту жидкости в бюретке. За начало опыта принять время третьего или четвертого измерения в условиях уже установившегося режима.
По опытным данным построить графики зависимости:
· разности объемов кислорода от времени [б∞–бф= f(t)] (на оси абсцисс откладывать время в минутах);
· скорости реакции от времени х = f(t). Скорость определяется по тангенсу угла наклона касательной к кривой б∞–бф= f(t) к оси времени;
· логарифма скорости реакции через различные промежутки времени от логарифма разности объемов выделенного кислорода
lgхф=f[lg(б∞–бф)];
· логарифма разности объемов кислорода от времени lg(б∞–бф)= f(t).
По последним двум графикам определить порядок реакции. Далее рассчитать константу скорости реакции при помощи графика lg(б∞–бф)= f(t) и методом подбора уравнений, где концентрации заменяются разностью объемов кислорода:
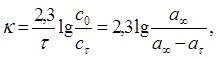
где б∞ – объем кислорода, выделившийся после разложения всего пероксида водорода (определяется как разность уровней в бюретке в момент, принятый за начало реакции, и после кипячения Н2О2 до полного разложения). Результаты представить в виде четырех графиков и табл. 6.3: