Методика выполнения работы
По объёму вытесненного водорода можно определить молярные массы эквивалентов активных металлов (магния, алюминия, цинка и т.д.), способных вытеснять водород из разбавленных кислот.
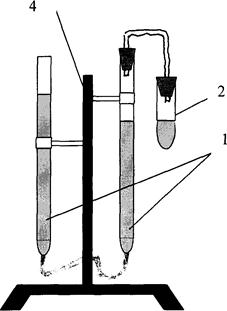
Прибор для определения молярной массы эквивалента металлов изображён на рис. 1.1. и состоит из:
|
двух бюреток 1 на 50 см3, соединённых резиновой трубкой, реакционной пробирки 2, газоотводной трубки 3, штатива 4.
Перед началом работы испытывают прибор на герметичность. Для этого соединяют верхний конец правой бюретки с пробиркой, опускают левую бюретку на 15–20см, закрепляют её в держателе штатива и наблюдают 3–5 мин. за положением уровня воды в ней. Если прибор герметичен, то уровень воды в бюретке за это время не изменяется. При изменении уровня нужно исправить дефект в приборе (обратившись к преподавателю за консультацией). После этого наливают в пробирку 4–5 см3 2,5 М раствора хлористо-водородной кислоты, 5 капель раствора Со(NO3)2 –. катализатора. Рис.1.1 Папиросную бумагу с навеской металла смачивают каплей воды и приклеивают к внутренней стенке пробирки над кислотой. Пробирку c кислотой и металлом плотно присоединяют к прибору; бюретки устанавливают так, чтобы уровни воды в них были одинаковы.
Записывают показатели бюретки до опыта. Затем встряхивают пробирку и металл падает в кислоту. Тотчас начинается выделение водорода и вода вытесняется из правой бюретки в левую. Левую бюретку при этом надо опускать, и во время опыта стараться держать воду в бюретках на одном уровне, чтобы давление газа внутри прибора было все время близко к атмосферному.
Пока идёт реакция, студент записывает показания барометра и термометра; по табл. 1 определяет давление насыщенных паров воды.
Когда весь металл растворится, прекратится понижение уровня воды в бюретке. Окончательный точный отсчёт показаний бюретки производится после охлаждения пробирки до комнатной температуры (через 10–15 мин.).
Результаты измерений записывают по форме:
Масса металла, m=..., г.
Показания бюретки до проведения реакции V1=..., см3.
Показания бюретки после реакции V2=..., см3.
Объём выделившегося водорода VH2 =V2 – V1=..., см3.
Температура окружающей среды t=..., ° С; Т=273 +t= ..., К.
Атмосферное давление Р=..., Па.
Давление насыщенных паров воды 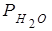 = ..., Па
= ..., Па
Парциальное давление водорода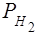 =
= 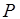 -
- 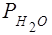 = ..., Па .
= ..., Па .
Объём выделившегося водорода приводят к нормальным условиям на основании уравнения состояния идеального газа, объединяющего законы Бойля-Мариотта и Гей-Люссака:
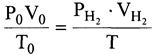 ,
,
где P0 – нормальное давление, равное 101325 Па; Vo – объём газа при нормальных условиях, см3; Т0 – 273 К; 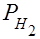 – парциальное давление сухого водорода;
– парциальное давление сухого водорода; 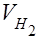 – объём газа в условиях опыта; Т – температура опыта по абсолютной шкале температур.
– объём газа в условиях опыта; Т – температура опыта по абсолютной шкале температур.
Таким образом, объём водорода, приведённый к нормальным условиям, определяется по уравнению
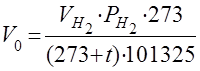 .
.
По закону эквивалентов, в случае когда одно из реагирующих веществ находится в твёрдом состоянии, а второе – в газообразном, молярная масса эквивалента металла определяется по формуле
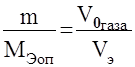 ,
,
где m – масса металла; МЭоп – молярная масса эквивалента металла; Vo –объём газа, приведённый к нормальным условиям; Vэ – молярный объём эквивалента газа. Молярный объём эквивалента водорода, составляющий 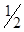 объёма его моля, занимает при нормальных условиях 11200 см3/моль.
объёма его моля, занимает при нормальных условиях 11200 см3/моль.
Затем студенты вычисляют теоретическую величину молярной массы эквивалента металла и находят относительную ошибку определения:
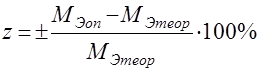 .
.
В конце работы записываются выводы.