Типы окислительно-восстановительных реакций
Опыт №3. Реакции межатомного взаимодействия. Окисление цинка йодом (опыт проводить под тягой)
Поместить в фарфоровую чашку немного цинковой пыли на кончике микрошпателя и прибавить туда же несколько кристаллов йода. Смесь перемешать. Для ускорения реакции прибавить 1 каплю Н2О (катализатор). Что наблюдается? Атомы какого элемента являются окислителем? Восстановителем? Составить уравнение реакции на основе электронного баланса.
Опыт №4. Реакции межмолекулярного взаимодействия. Окисление йодида солью трёхвалентного железа
В пробирку налить 1–2 см3 раствора соли железа (3) и 1 см3 раствора KI. Содержимое пробирки разбавить дистиллированной водой до слабо-жёлтого цвета и прилить 1–2 капли раствора крахмала. О чём свидетельствует появление синей окраски? На основе электронного баланса составить уравнение реакции.
Опыт №5. Окислительно-восстановительные реакции с участием атомов одного элемента в разных степенях окисления
Налить в пробирку 1–2 см3 раствора перманганата калия, прилить столько же раствора сульфата марганца. Осторожно встряхнуть пробирку. При этом окраска реакционной смеси изменится. Составить уравнение реакции в нейтральной среде, если одним из продуктов является диоксид марганца, выпадающий в осадок.
Опыт №6. Реакции внутримолекулярного окисления-восстановления. Разложение перманганата калия
Осторожно нагреть в сухой пробирке небольшое количество (несколько кристаллов) перманганата калия в течение 5 мин. После остывания пробирки полученную соль растворить в небольшом количестве воды. Обратить внимание на зелёную окраску раствора и наличие осадка. Составить уравнение реакции на основе электронного баланса.
Опыт №7. Реакции самоокисления-самовосстановления (диспропорционирования). Разложение сульфита натрия
В пробирку поместить несколько кристаллов сульфита натрия. Осторожно нагреть пробирку в течение 5 мин. После охлаждения налить в пробирку небольшое количество воды, добиваясь полного растворения вещества. Раствор разделить на две пробирки. Содержимое одной из пробирок испытать на присутствие иона S2- действием раствора СuSO4, а в другой пробирке, действуя раствором BaCl2, обнаружить ион 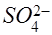 . Составить уравнение реакции самоокисления-самовосстановления на основе электронного баланса.
. Составить уравнение реакции самоокисления-самовосстановления на основе электронного баланса.