Результаты опытов
| Опускаемый металл | Ионы металлов в растворе | |||||
| Zn2+ | Fe2+ | Sn2+ | Pb2+ | Си2+ | Ag+ | |
| Zn | ||||||
| Fe | ||||||
| Sn | ||||||
| Pb | ||||||
| Си |
Заполнить таблицу данными своих наблюдений, поставив знак (+) под ионами металлов в тех случаях, когда эти металлы вытеснялись из их солей в свободном состоянии при действии тем или другим чистым металлом, и знак (-) в случаях, когда вытеснения не происходило.
Расположить исследованные металлы в порядке убывания их восстановительной активности, выписать их стандартные электродные потенциалы и сравнить соответствие экспериментально составленного вытеснительного ряда металлов ряду напряжений.
Опыт №2. Изготовление гальванического элемента
Из цинковой и медной пластинок и растворов солей этих металлов собрать гальванический элемент по схеме: Zn/Zn2+//Cu2+/Cu. В батарейный стакан «а» (рис.11.1.) до 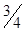 его объёма налить 1 М раствор соли металла, являющегося анодом, а в батарейный стакан «б» – такой же объём 1 М раствора соли металла, являющегося катодом. Оба стакана соединить U_- образной трубкой, заполненным насыщенным раствором хлорида калия в смеси с агар-агаром. В стакан «а» погрузить анод, а в стакан «б» – катод.
его объёма налить 1 М раствор соли металла, являющегося анодом, а в батарейный стакан «б» – такой же объём 1 М раствора соли металла, являющегося катодом. Оба стакана соединить U_- образной трубкой, заполненным насыщенным раствором хлорида калия в смеси с агар-агаром. В стакан «а» погрузить анод, а в стакан «б» – катод.
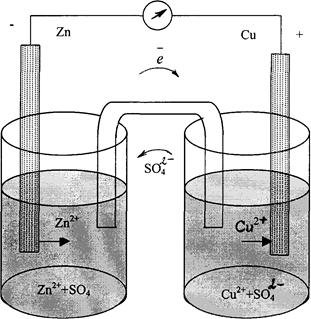
Рис.11.1
Смонтировать гальванический элемент и измерительные приборы по рис. 11.2.
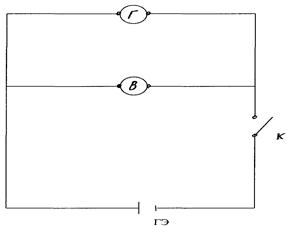
Рис.11.2
Замкнуть цепь и заметить по гальванометру направление тока. Через пять минут после замыкания цепи вольтметром измерить ЭДС работающего гальванического элемента, после чего разомкнуть цепь. Подсчитать теоретическую величину ЭДС элемента и определить перенапряжение.
Величина ЭДС работающего элемента Е всегда меньше, чем рассчитанная по формуле Нернста, вследствие того, что анодный процесс тормозится за счёт накопления на аноде ионов металла и потенциал анода становится более положительным, чем электродный потенциал данного металла; катодный процесс тормозится накоплением избыточных электронов, и потенциал катода становится более отрицательным.
Результаты работы записать в следующем порядке:
- схема гальванической цепи;
- уравнение процесса окисления на аноде;
- уравнение процесса восстановления на катоде;
- теоретическая величина ЭДС работающего элемента;
- суммарное уравнение реакции окисления-восстановления, протекающей
в гальваническом элементе.
Сделать вывод, является ли исследованный гальванический элемент практически поляризующимся.
Опыт №3. Гальванический элемент с водородной деполяризацией Собрать гальванический элемент: Zn/ZnSО4//H2SО4/H2(Cu)
В батарейный стакан «а» налить до 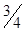 объёма 1 М раствора сульфата цинка и погрузить анод, а в стакан «б» налить такой же объём 1 М раствора серной кислоты и погрузить в него катод. Оба стакана соединить электролитическим ключом (U-образным сифоном). Смонтировать гальванический элемент и приборы по рис. 11.2. Замкнуть цепь и заметить по гальванометру направление тока.
объёма 1 М раствора сульфата цинка и погрузить анод, а в стакан «б» налить такой же объём 1 М раствора серной кислоты и погрузить в него катод. Оба стакана соединить электролитическим ключом (U-образным сифоном). Смонтировать гальванический элемент и приборы по рис. 11.2. Замкнуть цепь и заметить по гальванометру направление тока.
Через пять минут измерить вольтметром ЭДС работающего гальванического элемента, разомкнуть цепь. Подсчитать теоретическую величину ЭДС элемента, имея в виду, что катодом является водородный электрод. Определить величину перенапряжения.
Результаты опыта записать по форме:
- схема гальванической цепи;
- уравнение процесса окисления на аноде;
- уравнение процесса восстановления на катоде;
- теоретическая величина ЭДС;
- ЭДС рабочего элемента;
- величина перенапряжения на катоде;
- суммарное уравнение реакции окисления-восстановления, протекающей в гальваническом элементе. Сделать вывод, является ли исследованный элемент поляризующимся?