Методика выполнения работы
Все опыты проводятся в электролизере, представленном на рис. 13.1.
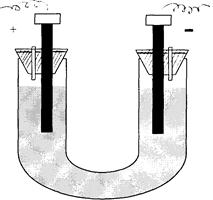 рис.13.1
рис9.9.1
рис.13.1
рис9.9.1
|
Опыт №1. Электролиз раствора хлорида двухвалентного олова
Заполнить электролизер 0,5 М раствором двухвалентного олова. В оба колена электролизера опустить угольные электроды и соединить их с медными проводами через реостат с выпрямителем переменного тока. Электролиз ведут при напряжении 4–5 В и силе тока 0,5 А. На катоде наблюдают появление серебристых кристаллов металлического олова.
Окисление или восстановление происходит на катоде? Написать уравнение катодного и анодного процессов. Доказать образование свободного хлора на аноде, для чего через 5 мин. пропускания электрического тока выключить выпрямитель, вынуть анод из электролизера и прибавить в анодное пространство по 3–4 капли растворoв йодида калия и крахмала. Наблюдать появление синего окрашивания. Описать наблюдаемые явления и ответить на поставленные по ходу работы вопросы.
Опыт №2. Электролиз раствора йодида калия
В коническую колбу налить примерно 20–25 см3 0,5 М раствора йодида калия и добавить по 5–6 капель фенолфталеина и раствора крахмала. Раствор перемешать и заполнить им электролизер. Опустить в него угольные электроды и присоединить их к источнику постоянного тока. Электролиз ведут при напряжении 8–10 В и силе тока 1–1,5 А в течение 5 мин.
Отметить изменение цвета раствора около анода и катода. Написать уравнение анодного и катодного процессов. Почему окрасились растворы в катодном и анодном пространствах? Окисление или восстановление йода произошло на аноде?
По окончании опыта анод промыть тиосульфатом натрия для более полного удаления йода с его поверхности и дистиллированной водой.
Опыт №3. Электролиз раствора сульфата натрия
Налить в электролизер 0,5 М раствор сульфата натрия. В анодное пространство внести 2–3 капли метилоранжа, а в катодное – 2–3 капли фенолфталеина. Погрузить угольные электроды и соединить с источником постоянного тока. Электролиз проводят при напряжении 5-6 В и силе тока 0,5 А в течение 5–10 мин. Наблюдать выделение пузырьков газа на электродах и изменение окраски раствора в анодном и катодном пространствах. Написать уравнения анодного и катодного процессов, протекающих при электролизе сульфата натрия. Какие вещества выделяются на аноде и катоде? Объяснить изменение окраски фенолфталеина в катодном пространстве и метилоранжа в анодном. Что окисляется и что восстанавливается?
Опыт №4. Никелирование медной пластинки
а). Подготовка предметов к покрытию их металлами. Механическая обработка. Полоску меди длиной 3–4 см, шириной 1 см с прикреплённой к одному концу медной проволокой тщательно очистить наждачной бумагой.
б). Обезжиривание. Очищенную пластинку опустить на 1–2 мин. в стаканчик с 5 М раствором NaOH, после чего промыть её водой из промывалки, держа за конец, к которому прикреплён проводник. Не касаться руками пластинки.
в). Травление. Обезжиренную пластинку опустить на 1–2 мин. в 2 М раствор серной кислоты с целью освободить поверхность металла от оксида. Снова промыть пластинку водой из промывалки и положить на кусочек фильтровальной бумаги.
г). Никелирование. В стакан ёмкостью 50 см3 налить на 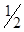 его объёма заготовленный заранее электролит никелирования (50 г сульфата никеля и 25 г хлорида аммония в 1 л воды) и опустить в него никелевую и медную пластинки. Соединить их с источником постоянного тока так, чтобы медная пластинка была катодом, а никелевая анодом. Через несколько минут наблюдать покрытие никелем той части медной пластинки, которая была погружена в раствор электролита.
его объёма заготовленный заранее электролит никелирования (50 г сульфата никеля и 25 г хлорида аммония в 1 л воды) и опустить в него никелевую и медную пластинки. Соединить их с источником постоянного тока так, чтобы медная пластинка была катодом, а никелевая анодом. Через несколько минут наблюдать покрытие никелем той части медной пластинки, которая была погружена в раствор электролита.
Написать уравнения катодного и анодного процессов. Объяснить наблюдаемое явление.