ТЕМА: Властивості похідних карбонових кислот
Основні теоретичні відомості
Естери — продукти заміщення атомів Гідрогену гідроксильної групи карбонових і мінеральних кислот на карбоновий радикал. Розрізняють моно-, ди- і поліестери.
Для естерів аналогічно етерам характерна ізомерія карбонових радикалів і метамерія. Назва естеру складається від назви кислоти і спирту, що беруть участь у його утворенні. Згідно з номенклатурою ІЮПАК назви естерів утворюються так: беруть у вигляді радикала назву спирту, додають найменування кислоти як вуглеводню і закінчення - оат. Наприклад, структурні формули естерів (ізомери і метамери), що відповідають молекулярній формулі C4H8O2,за різними номенклатурами називаються так:
O O
// //
H – C H – C CH3
/
O – CH2 – CH2 – CH3 O – CH
CH3
мурашинопропіловий естер, мурашиноізопропіловий естер,
пропіл форміат ізопропілформіат
(пропілметаноат) (ізопропілметаноат)
O O
// //
CH3 – C CH3 – CH2 – C
O – CH2 – CH3 O – CH3
оцтовоетиловий естер, пропіоновометиловий естер,
етилацетат метилпропіонат
(етилетаноат) (метилпропаноат)
Естери одержують реакціями етерифікації, з солей Ag (I) і галогеноалкінів; реакціями приєднання карбонових кислот до ацетилену; з галогенгідридів і алкоголятів або спиртів.
Хімічні властивості естерів представлені реакціями гідролізу; переестерифікації; відновлення ; амінолізу.
Мила - лужні та лужноземельні солі ВЖК, нафтенових і смоляних кислот. Близькі за своєю дією до мил поверхнево-активні речовини (ПАР), розчини яких здатні очищувати забруднені поверхні предметів.
Мила класифікують за консистенцією (тверді, мазеподібні, рідкі), розчинністю (розчинні та нерозчинні), призначенням (господарські, туалетні, медичні, технічні).
Тверді мила — це натрієві солі ВЖК (стеаринової і пальмітинової), рідкі мила — калієві солі ВЖК (олеїнової, лінолевої, ліноленової), нерозчинні - солі різних ВЖК і деяких металів (Са, Pb, Cu).
Синтетичні миючі засоби (СМЗ), або детергенти - композиції різного складу, основою яких є одержані методами органічного синтезу і з нехарчової сировини різноманітні ПАР.
Ангідриди карбонових кислот - це продукти дегідратації їх молекул:
O O
// //
R – C R – C
 O – H
O – H 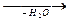 O
O
 O – H /
O – H /
/ R – C
R – C \
\ O
O
карбонові кислоти ангідрид карбонових кислот
Для ангідридів карбонових кислот існує ізомерія радикалів. При найменуванні ангідридів карбонових кислот частіше користуються історичною номенклатурою.
Способи одержання: дія оксиду фосфору (V) на карбонові кислоти; взаємодія галоген-ангідридів з безводними солями карбонових кислот. До хімічних властивостей відносяться реакції гідролізу; амоноліз ангідридів; реакції алколізу.
Галогенангідриди карбонових кислот - це похідні карбонових кислот, у яких гідроксил карбоксильної групи заміщений на атом галогену.
Для галогенангідридів існує ізомерія радикалів, їх найчастіше називають за ацильною групою:
O O O
// // //
H – C CH3 – C C6H5 – C
Cl Cl Cl
хлористий форміл хлористий ацетил хлористий бензоіл
Галогенангідриди карбонових кислот одержують: дією на кислоти галогенідів фосфору (III), (V), або тіонілхлориду, дією на ангідриди тіонілхлориду.
Хімічні властивості: гідроліз галогенангідридів; реакція алколізу, реакція амонолізу; відновлення галогенангідридів до спиртів.
Аміди кислот - продукти заміщення гідроксилу карбонільної групи на залишок аміаку, або аміногрупу.
Для амідів кислот властива ізомерія радикала кислот і таутомерія. При найменуванні амідів кислот до слова «амід» додають назву кислоти або ацилу (амід оцтової кислоти, або ацетамід).
Одержують аміди кислоти: нагріванням амонійних солей; амонолізом галогеноангідридів; взаємодією ангідридів карбонових кислот з аміаком; дією аміаку на естери.
Хімічні властивості: утворення солей з міцними мінеральними кислотами; розклад молекул амідів кислот під дією нітратної кислоти; утворення солей з оксидами; гідроліз амідів; утворення нітрилів; утворення амінів.