рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- З органічної хімії
Реферат Курсовая Конспект
З органічної хімії
З органічної хімії - раздел Химия, Міністерство Освіти І Науки України Криворізькій Технічний Університ...
Міністерство освіти і науки України
Криворізькій технічний університет
Кафедра хімії
МЕТОДИЧНІ ВКАЗІВКИ
До виконання лабораторних та самостійних робіт
З органічної хімії
для студентів І і II курсів напрямів «Екологія» та «Гірництво»ЛАБОРАТОРНА РОБОТА № 1
ТЕМА: Добування і властивості вуглеводнів аліфатичного ряду
Основні теоретичні відомості
Вуглеводні - речовини, молекули яких складаються з двох хімічних елементів: карбону і гідрогену. Структуру молекул насичених вуглеводнів та їх ізомерію пояснюють за допомогою теорії хімічної будови органічних сполук…ХІД РОБОТИ
ДОСЛІД 1. Добування та властивості метану
Метан - найпростіший вуглеводень. Найчастіше його добувають з ацетату натрію реакцією Дюма. У суху пробірку вносять 10-15 г суміші, що складається з однієї частини… ХІМІЗМ. Метан утворюється при термічному розкладенні ацетату натрію лугом:ВИСНОВОК: Розчин не змінює забарвлення.
Метан не здатний за звичайних умов вступати в реакцію окислення з киснем повітря або атомарним оксигеном.
Добутий у досліді 1 метан через газовідвідну трубку пропускають у пробірку, у яку заздалегідь налито 2-3 мл 0,5-1% розчину перманганату калію.
ВИСНОВОК: Розчин не змінює забарвлення.
Добутий у досліді 1 метан після пропускання крізь воду, розчини йоду в йодиді калію і перманганату калію підпалюють.
ХІМІЗМ. Під час горіння метану утворюється вуглекислий газ і вода:
CH4 + 2O2 → CO2 + 2H2O
ВИСНОВОК: Газ горить синім полум'ям.
ДОСЛІД 2. Добування та властивості етилену.
У суху пробірку вміщують 2-3 мл суміші - 1 частину етанолу і 3 частини Н2SO4 конц. Пробірку після внесення кип'ятильних камінців закривають пробкою… ХІМІЗМ. Реакція добування етилену грунтується на відщепленні від молекули… І етап – H3C – CH2 – OH + HO – SO2OH → H3C- CH2 – OSO2OH + H2OВИСНОВОК: Розчин знебарвлюється, оскільки етилен приєднує йод, що призводить до розривання зв'язку й утворення насиченої галогенопохідної вуглеводню.
У пробірку наливають 5 мл 1% розчину перманганату калію, підлуженого розчином Na2CO3. Через газовідвідну трубку у суміш пропускають етилен. Розчин перманганату калію спочатку буріє, потім випадає бурий осадок МnО2 . … ХІМІЗМ.ВИСНОВОК: Відбувається реакція окислення - відновлення, під час якої семивалентний манган відновлюється до чотиривалентного, а етилен окислюється до двохатомного спирту етиленгліколю.
Етиленові вуглеводні горять.
До отвору газовідвідної трубки підносять запалений сірник і етилен займається, на відміну від горіння метану полум'я кіптяве. Якщо у полум'я внести фарфоровий тигель, на ньому утвориться сажа, що свідчить про наявність у ньому карбону.
ХІМІЗМ.
CH2 + 2O2 → CO2↑ + 2H2O + C
||
CH2
CH2 + 3O2 → 2CO2↑ + 2H2O
||
CH2
ВИСНОВКИ: За недостатньої кількості кисню у процесі горіння утворюється вуглекислий газ, вода і карбон. У разі насиченості повітря киснем полум'я має блакитне забарвлення, не кіптяве - етилен згоряє до вуглекислого газу і води.
ДОСЛІД 3. Добування та властивості ацетилену.
Реакція добування ацетилену розроблена німецьким хіміком Ф. Велером (1862). У суху пробірку без дна вміщають на шматочку скловати кілька кусочків карбіду… Виділяється ацетилен.Ca + 2HOH →
Ca(OH)2 / CH C карбід кальцію ацетилен
ВИСНОВОК: Ацетилен утворюється у результаті взаємодії карбіду кальцію з водою.
Газовідвідну трубку занурюють у пробірку з 3-5 мл розчину йоду у розчині йодиду калію. Відбувається знебарвлення суміші. ХІМІЗМ. І етап – H – C ≡ C – H + I 2 →H – C = C – HВИСНОВОК: Наявність у суміші йоду сприяє розриванню потрійного зв'язку в молекулі ацетилену.
У пробірку наливають 2-3 мл 1% розчину KMnO4, підлуженого розчином соди. Крізь розчин пропускають ацетилен. Розчин буріє, а через кілька хвилин випадає коричневий осад МnО2.CH – OH OH H CH ацетилен етендіол-1,2 2-гідроксиетаналь ІІ етап – O 2 1 // COOH CH2 – C + 3O → | + H2O | COOH OH H 2-гідроксиетаналь оксалатна кислота
ВИСНОВОК: Розчин перманганату калію окислює ацетилен у лужному середовищі до оксалатної кислоти.
Атоми гідрогену у молекулі ацетилену вступають у реакцію заміщення на атоми аргентуму. У пробірку наливають 2-3 мл 1-3 % розчину нітрату аргентуму, додають… Крізь цей розчин пропускають ацетилен. Випадає осад - ацетиленід аргентуму.Ag(NH3)2]OH →
NH3 + 2H2O CH CAg ацетилен ацетиленід аргентуму
ВИСНОВКИ: Утворення ацетилену аргентуму відбувається у два етапи: спочатку утворюється аміачна сіль гідроксиду аргентуму, потім - ацетиленід аргентуму.
Атоми гідрогену у молекулі ацетилену вступають у реакцію з атомами купруму, що приводять до утворення ацетиленіду купруму.
У пробірку наливають 2-3 мл аміачного розчину хлориду купруму (І).
У розчин пропускають ацетилен.
Суміш забарвлюється у коричнево-червоний колір, а через деякий час випадає червоний осад.
ХІМІЗМ.
І. CuCl + 3NH3 + H2O → [Cu(NH3)2]Cl + NH4OH
II.
CH CCu
Cu(NH3)2]Cl →
NH4Cl + 2NH3 CH CCu ацетилен ацетиленід купруму (І)
ВИСНОВОК. Утворення ацетиленіду купруму (І) відбувається у два етапи: спочатку утворюється аміачна сіль хлориду купруму, потім -ацетиленід купруму (І).
Ацетилен через газовідвідну трубку пропускають у зовнішнє середовище і запалюють. Він горить кіптявим полум'ям. Суміш ацетилену з повітрям вибухонебезпечна !
ХІМІЗМ.
2HC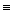 CH + 3O2 → 2CO2↑ + 2H2O + 2C
CH + 3O2 → 2CO2↑ + 2H2O + 2C
ацетилен
CH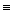 CH + 2 ½ O2 → 2CO2 + H2O
CH + 2 ½ O2 → 2CO2 + H2O
ацетилен
ВИСНОВКИ: Ацетилен горить. У разі нестачі кисню під час горіння виникає кіптяве полум'я в результаті надлишку у молекулі вуглеводню карбону. За високого вмісту кисню в атмосфері ацетилен згорає без кіптяви.
КОНТРОЛЬНІ ЗАПИТАННЯ І ЗАВДАННЯ
до самостійної роботи
1. Назвіть основні положення теорії хімічної будови органічних сполук О.М. Бутлерова.
2. Сформулюйте основні принципи теорії хімічної будови органічних сполук.
3. Виведіть структурні формули перших п'яти членів гомологічного ряду метану.
4. Які номенклатури органічних сполук вам відомі?
5. Напишіть структурні формули таких алканів і назвіть їх за номенклатурою IUPAC:
а) триметилметан;
б) диметилетилметан;
в) метилетилпропілбутилетан;
г) триізопропілметан.
6. Напишіть структурні формули таких алкенів:
а) 3 - етилпентан;
б) 2,4 - диметилпентан;
в) 3 - метил -3 -етилпентан;
г) 2,2 - диметил - 3 - етилгексан;
д) 3 - етилгептан;
е) 2 - метил - 3 етил - 4 - пропілнонан.
7. Напишіть структурні формули:
3,4 - диметилгексан;
2,3,2 - триметилгептан;
2,2,4 - триметил;
3,5 – диетилдекан.
8. Напишіть структурні формули таких алкенів:
2 - метилпропен - 1;
2 - метилгексен - 3;
2,4 - диметилгексен - 3; 2,2,3,5 - тетраметилгептен - 3.
9. Напишіть структурні формули таких алкенів:
метилацетилен;
диметилацетилен;
метилетилацетилен;
ізопропілацетилен;
дізопропілацетилен.
10. Напишіть структурні формули таких алкінів:
бутин - 1;
метилпентин - 1;
гексин - 1;
гептин - 3;
2 - метил - 5 - етилгептин - 3;
2,2,5,5 - тетраметилгептин - 3.
11. Напишіть можливі рівняння хімічних реакцій добування бутадієну.
ЛАБОРАТОРНА РОБОТА № 2
ТЕМА: Галогенопохідні
Основні теоретичні відомості. Галогенопохідні вуглеводнів - продукт заміщення одного або кількох атомів гідрогену у молекулах вуглеводнів на атом…ХІД РОБОТИ
ДОСЛІД 1. Добування йодоформу.
У пробірку наливають 10-20 крапель етанолу, додають кілька кристалів йоду і 2-3 мл дистильованої води. Суміш збовтують і додають 30% розчин NaOH до… ХІМІЗМ: Утворення йодоформу відбувається у кілька стадій:ВИСНОВОК: На дно пробірки випадають зелено-жовті кристали йодоформу - речовини зі специфічним запахом.
ДОСЛІД 2. Отримання етилброміду (брометану).
У пробірку вливають 3 мл етанолу, додають 3 мл сульфатної кислоти, охолоджують. Додають 2 мл води, охолоджують, всипають 3 г броміду калію.… ХІМІЗМ. KBr + H2SO4 → HBr + KHSO4ВИСНОВОК: Етилбромід має вигляд масляної рідини, що важча за воду.
ДОСЛІД 3. Відщеплення галогену дією нітрату срібла у спиртовому розчині.
До 1-2 мл розчину нітрату аргентуму додають 1 краплю досліджуваного галогенопохідного. Якщо протягом 1-2 хвилин осад галогеніду аргентуму не… ХІМІЗМ. R – Hal + AgONO2 → Ag – Hal + RONO2ВИСНОВОК: Утворення галогеніду аргентуму супроводжується випаданням осаду.
ДОСЛІД 4. Взаємодія хлороформу та чотирьоххлористого вуглецю з лугом.
У пробірці № 1 проводять лужний гідроліз хлороформу. Для цього поміщають у пробірку декілька крапель хлороформу і 2-3 мл розбавленого розчину лугу,… У пробірці № 2 проводять лужний гідроліз чотирьоххлористого вуглецю. У… Гідролізати № 1 і № 2 ділять на три частини. З гідролізатами, що отримані у пробірці № 1 і № 2 окремо проводять…ВИСНОВКИ: У лужному середовищі хлороформ гідролізується, а чотирьоххлористий вуглець - ні. Це підтверджується якісними реакціями І, II, III.
Реакція І з гідролізатом №1 супроводжується випаданням осаду хлориду аргентуму. У реакції II з гідролізатом № 1 мурашина кислота, що одночасно є і альдегідом, окислюється до карбонатної кислоти, відновлюючи оксид аргентуму в аміачному розчині до металічного срібла.
У реакції III з гідролізатом № 1 відбувається окислення мурашиної кислоти. Початкове почорніння рідини відповідає моменту одночасної присутності іонів MnO4- (фіолетово-червоне забарвлення) і MnO42- (зелене забарвлення), і тому розчин поглинає промені світла всієї області видимого спектра.
КОНТРОЛЬНІ ЗАПИТАННЯ І ЗАВДАННЯ
до самостійної роботи
1. Напишіть формули ізомерів С5H11Cl і дайте їм назви за раціональною номенклатурою та номенклатурною IUPAK
2. Як можна добути 2-хлорпентан і 1,2 - дихлорпентан?
3. Напишіть схему рівнянь хімічних реакцій заміщення гідроксильної групи на галоген під час перетворення пропанолу на пропілхлорид.
4. Напишіть схему рівнянь хімічних реакцій перетворення первинного пропілхлориду на вторинний пропілхлорид.
5. Дайте коротку характеристику основних фізичних і хімічних властивостей галогенопохідних вуглеводнів.
ЛАБОРАТОРНА РОБОТА № 3
ТЕМА: Спирти
Спирти (алкоголі) - органічні сполуки, що містять у складі своїх молекул одну або кілька гідроксильних груп -ОН. Загальна формула насичених одноатомних спиртів CnH2n+lOH. Залежно від кількості гідроксильних груп спирти класифікують на одноатомні (алкоголі), двохатомні (гліколі),…ХІД РОБОТИ
ДОСЛІД 1. Відкриття наявності води в етанолі та його зневоднення.
Обладнання та реактиви: пробірки, випарювальні чашки, щипці, етанол, CuSO4∙5H2O
У пробірку наливають 1-2 мл етанолу і добавляють кілька кристалів прожареного білого порошку сульфату купруму, перемішують.
ХІМІЗМ.
CuSO4∙5H2O → CuSO4+5H2O
білий синій
ВИСНОВОК: При взаємодії сульфату купруму з водою утворюється кристалогідрат сульфату купруму. Спостерігають, як білий колір пропареного сульфату купруму стає синім.
ДОСЛІД 2. Утворення діетилового ефіру.
Змішують у пробірці 1 мл етанолу та 1 мл концентрованої сульфатної кислоти. Суміш обережно нагрівають на пальнику до початку кипіння. Далі доливають… ХІМІЗМ. ROH + HOSO2OH ROSO2OH + H2OВИСНОВКИ: При взаємодії первинних спиртів з концентрованою сульфатною кислотою спочатку утворюється неповний складний ефір – алкілсульфатна кислота. Спирт, у надлишку, діє на алкілсульфатну кислоту при нагріванні до 130-140°С аналогічно воді, при цьому регенерується сульфатна кислота й утворюється простий ефір.
ДОСЛІД 3. Окислення етанолу хромовою сумішшю.
Змішують у пробірці 2 мл розчину біхромату калію, 1 мл розбавленої сульфатної кислоти і 0,5 мл етанолу. Суміш нагрівають. ХІМІЗМ. K2Cr2O7 + 4H2SO4 + 3C2H5OH → K2SO4 + Cr2(SO4)3 + 3CH3COH + 3H2OВИСНОВОК: Протікання реакції окислення характеризується зміною забарвлення розчину, а утворення ацетатальдегіду за його характерним запахом.
ДОСЛІД 4. Окислення етанолу.
У пробірку поміщають 0,5 г перманганату калію, 3 мл дистильованої води і 0,5 мл етанолу. Нагрівають, при енергійній реакції пробірку охолоджують.… ХІМІЗМ. 2KMnO4 + H2O → 2KOH + 2MnO2 + 3O;ВИСНОВОК: Окислення супроводжується зміною забарвлення розчину та випадінням бурого осаду, що підтверджує запропонований хімізм реакції.
ДОСЛІД 5. Комплексоутворення багатоатомних спиртів
1. У пробірці отримують гідроксид, для цього до розбавленого розчину сульфату міді вводять розчин лугу у невеликому надлишку. Осад фільтрують.… 2. У пробірці струшують біля 0,5-1 г кристалічної бури з 10-15 мл води.… ХІМІЗМ. Утворення гліцерату купруму відбувається у два етапи.ВИСНОВКИ: Багатоатомні спирти мають помітні слабкі кислотні властивості. Кислотні властивості багатоатомних спиртів обумовлюються утворенням алкоголятів при взаємодії з гідратами оксидів металів. Якщо у молекулі спирту є дві сусідні гідроксильні групи, то гідрооксид купруму у лужному розчині спочатку утворює алкоголят міді, який перетворюється на комплексний катіон за участі 4 гідроксильних груп з координаційним числом 4. Комплексоутворювачем є катіон купруму (П), а лігандами — атоми оксигену. Ці комплексні іони обумовлюють інтенсивне синє або фіолетове забарвлення розчину. Кислоти руйнують ці сполуки з утворенням спирту та мідної солі кислоти, при цьому забарвлення зникає.
Розчин бури (Na2B4O7∙10H2O) має різко лужну реакцію. У розчині присутні аніони B4O72- і молекули ортоборної кислоти Н3ВО3 , що утворює складні ефіри з спиртами. Бор являється комплексоутворювачем з координаційним числом 4, а лігандами - атоми кисню. Ці комплекси є сильними кислотами.
КОНТРОЛЬНІ ЗАПИТАННЯ І ЗАВДАННЯ
до самостійної роботи
1. Які сполуки називають спиртами?
2. Які спирти називають первинними, вторинними, третинними? Навести приклади.
3. Напишіть структурні формули усіх спиртів, що відповідають формулі C4H9OH; C5H11OH; C6H13OH; C7H15OH; C8H17OH. Назвіть спирти за раціональною номенклатурою і номенклатурою ІЮПАК.
4. Способи отримання спиртів. Реакція гідролізу галогенопохідних вуглеводнів. Каталітичне окислення вуглеводнів.
5. Які спирти утворюються в результаті відновлення альдегідів та кетонів?
6. Отримання спиртів шляхом гідратації алкенів. Реакція гідратації етилену.
7. Що таке прості ефіри? У яких умовах вони утворюються?
8. Написати структурні формули:
а) 3-метилпентанол - 3;
б) 2,2-диметилбутанол - 1;
в) 2,4-диметилпентанол - 2;
г) бутандіол-2,3;
д) пропантріол - 1,2,3
9. написати рівняння перетворення
C2H2 → C2H5OH
10. Які спирти можна отримати дією водного розчину лугу на сполуки:
а) CH3 – CHІ – CH3
CH3
|
б) CH3 – C – CH3
|
Br
CH3
|
в) CH3 – CH – C – CH3
| |
CH3 Cl
11. Здійснити перетворення і назвати проміжні продукти:
CH4 +Cl2→A Na→Б -H2→B H2O→Г
ЛАБОРАТОРНА РОБОТА № 4
ТЕМА: Альдегіди та кетони
Альдегіди і кетони (оксосполуки) - похідні вуглеводів, у молекулах яких один або кілька атомів гідрогену заміщені на карбонільну групу = О. В альдегідів одна з валентностей атома карбону такої групи сполучена з… У молекулі кетону обидві валентності карбонільної групи сполучені з радикаламиХІД РОБОТИ
Обладнання та реактиви: пробірки, пальник 10% розчин їдкого натру, 10% розчин формаліну, розчин сульфату купруму. У пробірку наливають 2-3 мл 10% розчину NaOH і доливають 1 мл 10% розчину… ХІМІЗМВИСНОВОК: Блакитний осад гідроксиду купруму (II) взаємодіє з метаналем з утворенням мурашиної кислоти та червоного осаду купруму (І), може взаємодіяти з новими порціями метаналю, що зумовлено відкладанням на стінках пробірки тонкого шару металічної міді.
ДОСЛІД 2. Відновлення альдегідами сполук срібла (реакція «срібного дзеркала»).
У пробірку наливають 2-3 мл розчину нітрату аргентуму, далі краплями додають розчин аміаку до розчинення осаду гідроксиду аргентуму. До прозорого… ХІМІЗМ. AgNO3 + NH4OH →AgOH + NH4NO3ВИСНОВОК: Реакцію «срібного дзеркала» використовують у хімічному аналізі для виявлення альдегідів, а також для виготовлення та відновлення дзеркал.
ДОСЛІД 3. Добування уротропіну.
У фарфорову чашку вносять 2-3 мл розчину формаліну, додають 4-5 мл розчину аміаку і випарюють на водяному нагрівнику. ХІМІЗМ. ОВИСНОВОК: У результаті взаємодії розчину формаліну з аміаком, після випарювання, утворюється кристалічний осад уротропіну.
ДОСЛІД 4. Реакції уротропіну.
I. До 0,2-0,5г уротропіну добавляють 1мл. сульфатної кислоти, суміш нагрівають до кипіння. З'являється запах формальдегіду. Суміш охолоджують і… II. Розчиняють 0,2-0,5г уротропіну у 2-3 мл води і ділять розчин на дві… III. Декілька кристалів уротропіну нагрівають у пробірці і встановлюють, чи утворюються у результаті його розкладу…ВИСНОВКИ: Реакція утворення уротропіну оборотна але її рівновага здвинута праворуч. При нагріванні уротропіну з кислотами аміак зв'язується, а формальдегід виходить з реакції; при нагріванні з лугами виділяється аміак. В обох випадках рівновага здвигається ліворуч, відбувається гідроліз уротропіну.
Уротропін з нітратом аргентуму дає білий осад комплексної сполуки C6H12N4∙AgNO3, що розчиняється у надлишку уротропіну.
При нагріванні сухого уротропіну він возгоряється без розкладання, відщеплюється лише трохи аміаку.
Уротропін у вигляді таблеток використовується як тверде паливо.
ДОСЛІД 5. Отримання оксиму ацетону.
У широку пробірку наливають 7 мл води і розчиняють 2 г солянокислого гідроксиламіану і 1,5г безводної соди. Розчин охолоджують у льодяній воді.… ХІМІЗМ. 2 NH2OH + HCl + Na2CO3 → 2NH2OH + 2NaCl + CO2 + H2OВИСНОВКИ: При реакції альдегідів і кетонів з гідроксиламіном утворюються оксим і вода. Отримання оксимів використовують для ідентифікації альдегідів і кетонів.
КОНТРОЛЬНІ ЗАПИТАННЯ І ЗАВДАННЯ
до самостійної роботи
1. Які речовини називають альдегідами?
2. Які речовини називають кетонами?
3. Які речовини утворюються при окисленні первинних і вторинних спиртів?
4. Як отримати ацетальдегід із ацетилену?
5. Напишіть структурні формули:
а) пропаналь;
б) 3-метилбутаналь;
в) диізопропілкетон;
г) 3-метилпентаналь;
д) гептанон-2.
6. Напишіть рівняння реакції взаємодії бутаналю з:
а) ціанідною кислотою; б) аміаком; в) етанолом;
г) гідроксиламіном і назвіть продукти реакцій.
7. Здійсніть перетворення:
C2H6 
8. Які сполуки утворюються при гідратації у присутності солей Нg2+ сполук:
a) CH ≡ CH;
б) CH ≡ C – CH3;
в) H3C – C ≡ C – CH3
9. За яких умов можна здійснити перетворення:
CH3 – CHCl – CH3 ?→ CH3 – CH = СH2 ?→
?→CH3C ≡ CH ?→ CH3 – C – CH3
||
O
10. Назвати за міжнародною номенклатурою наступні речовини:
О
//
а) CH3 – CH – CH2 – C ;
|
CH3 H
О
//
б) CH3 – CH – CH – CH2 – C ;
| |
CH3 C2H5 H
О
//
в) CH3 – CH – CH2 – C .
|
C4H9 H
ЛАБОРАТОРНА РОБОТА № 5
ТЕМА: Карбонові кислоти
Карбонові кислоти - похідні вуглеводнів, у молекулах яких один або кілька атомів гідрогену заміщені карбоксильною групою - СООН. Формула гомологічного ряду кислот СnH2nO2 або CnH2n+1COOH для дикарбонових кислот СnН2n(СООН)2, залежно від природи радикала їх поділяють на ациклічні…ХІД РОБОТИ
ДОСЛІД 1. Розчинність у воді карбонових кислот та їх солей.
Декілька крапель або кристалів кожної з кислот збовтують з 1-2 мл води у пробірці; якщо кислота не розчиняється, суміш нагрівають . Для всіх проб… Охолоджуючи суміші, відмічають, чи виділяються знову кристали кислоти, що… Проби, що мають осад малорозчинної кислоти, збовтують, потім частину суспензії переливають в інші пробірки і додають…ВИСНОВКИ: Одноосновні карбонові кислоти, що містять менше шести атомів карбону добре розчинні у воді. Зі збільшенням числа гідрофільних груп - карбоксильних, гідроксильних - у молекулі кислоти розчинність кислот у воді зростає, а зі збільшенням числа атомів карбону розчинність знижується. Органічні кислоти добре розчиняються у розчинах лугів, утворюючи солі.
ДОСЛІД 2. Порівняння ступеня іонізації кислот.
Випробовують дію на папірці конго водних розчинів різних кислот однакової концентрації (отриманих у попередньому досліді). Проводять по сухому папірцю риску тонкою паличкою, що змочена відповідним… Для порівняння досліджують воду, розчини гліцерину і фенолу, та розбавлену сульфатну (хлоридну) кислоту.ВИСНОВКИ: При дії слабких кислот папірці конго забарвлюються у коричнево-чорний колір, котрий з часом блідніє. При дії більш сильних кислот - у синювато-чорний, а при дії найсильніших - у стійкий синій колір. Дослідження кислоти розташовують у ряд за зростаючим ступенем кислотності.
ДОСЛІД 3. Витіснення кислот з їх солей іншими кислотами.
В окремі пробірки поміщають невеликі кількості кожної з солей оцтової, карбонатної та янтарної кислот і додають по декілька крапель розчину… Витіснення карбонатної кислоти характеризується виділенням двооксиду вуглецю,…ВИСНОВКИ: Слабкі кислоти витісняються зі своїх солей більш сильними кислотами завдяки виділенню слабкої кислоти (H2CO3) зі сфери реакції внаслідок розпаду, з виділенням газу рівновага здвигається і процес легше помітити. Виділяють СО2 з розчину бікарбонату також сульфокислоти, ди- і тринітрофеноли та інші сполуки кислотного характеру.
ДОСЛІД 4. Різниця в окислюваності органічних кислот.
Готують водні розчини досліджуваних органічних кислот, змішуючи 0,05-0,1 г кислоти і 1-2 мл води. До кожного з отриманих розчинів додають 1 мл…ВИСНОВКИ: Одноосновні насичені кислоти нормальної будови, за винятком мурашиної кислоти, стійкі по відношенню до окислювачів. Недостатньо чиста оцтова кислота може містити домішки, що окислюються і дещо змінюють забарвлення розчину КМnО4. Мурашина кислота, що за будовою є також і альдегідом, окислюється з утворенням CO2 та води.
Щавлева кислота, що переходить у мурашину з відщепленням СО2, також окисляється перманганатом калію у кислому середовищі. Малонова кислота також легко окислюється, інші гомологи двоосновних кислот більш стійкі до окислювачів.
Для оксикислот, зі збільшенням числа гідроксильних груп у молекулі кислоти, здатність до окислення підвищується.
Ненасичені кислоти окислюються КМnО4 до розщеплення молекули за місцем подвійного зв'язку.
Окислення кислот KMnO4 легше проходить у кислому середовищі.
КОНТРОЛЬНІ ЗАПИТАННЯ І ЗАВДАННЯ
до самостійної роботи
1. Які органічні сполуки називають карбоновими кислотами ?
2. Номенклатура кислот. Які назви згідно з правилами міжнародної номенклатури мають мурашина, оцтова, пропінова та масляна кислота ?
3. Способи отримання кислот. За яких умов отримують карбонову кислоту із спиртів та альдегідів ?
4. Які кислоти утворяться при окисленні етанолу, пропаналя, метаналя, 2-метилпропаналя?
5. Ізомерія карбонових кислот . Зобразити всі ізомери гексанової кислоти.
6. Реакційна здатність карбонових кислот. Реакція за карбоксильною групою.
7. Взаємодія карбонових кислот з металами та розчинами лугів.
8. Написати графічні формули і назвати за номенклатурою кислоти, що утворюються при окисленні:
а) метаналя;
б) 2,2 - диметилбутаналя -1;
в) З-метилпентаналя-4;
г) бутаналя -2.
9. Здійснити перетворення
CH ≡ CH  [0] → Б
[0] → Б
10. Скласти рівняння реакцій між мурашиною кислотою і:
а) цинком;
б) гідроксидом кальція.
11. Вказати умови проведення наступних перетворень :
CH3 – CH3  CH ≡ CH
CH ≡ CH  CH3 – COH
CH3 – COH  CH3COOH
CH3COOH
12. Здійснити перетворення:
CH3 – CH2CHCl2 NaOH→A [O]→Б NaOH→В
ЛАБОРАТОРНА РОБОТА № 6
ТЕМА: Властивості похідних карбонових кислот
Естери — продукти заміщення атомів Гідрогену гідроксильної групи карбонових і мінеральних кислот на карбоновий радикал. Розрізняють моно-, ди- і… Для естерів аналогічно етерам характерна ізомерія карбонових радикалів і…ХІД РОБОТИ
ДОСЛІД І. Добування етилетаноату (етилацетату).
У пробірку вносять 1-2 мл концентрованої ацетатної кислоти, добавляють такий самий об'єм 80-96% етанолу і 1-1,5 мл концентрованої сульфатної… ХІМІЗМ. Реакція етерифікації відбувається у дві стадії: спочатку утворюється проміжний продукт - етилсульфатна кислота, потім…ВИСНОВКИ: Реакція етерифікації оборотна. Тобто, одночасно з етерифікацією має місце гідроліз утвореного складного ефіру. Активним каталізатором для обох реакцій - прямої і оборотної являються іони гідрогену. Сульфатна кислота, що додається до реакційної суміші, не лише забезпечує високу концентрацію іонів гідрогену у суміші: але може одночасно зв'язувати воду, що утворюється під час реакції, і здвигати рівновагу в сторону утворення складного ефіру.
ДОСЛІД 2. Взаємодія ацетатного ангідриду з водою та спиртом.
А. У пробірку наливають 1 мл води і 0,5-1 мл ацетатного ангідриду. Струшують пробірку, нагрівають до початку кипіння, відмічають, коли важкі краплі… Б. У дві пробірки поміщають по 1 мл спирту і додають по 1 мл ацетатного… У другу пробірку вносять краплю концентрованої сульфатної кислоти. Суміш збовтують, щоб уникнути скипання, пробірку…ВИСНОВКИ: Ангідриди карбонових кислот нерозчинні у воді. Вони реагують з водою і спиртами значно повільніше, ніж хлорангідриди. В умовах досліду Б ацетатний ангідрид не встигає повністю прореагувати з спиртами навіть при нагріванні у гомогенному середовищі. У присутності каталізатора (H2SO4 конц.) швидкість реакції різко збільшується.
ДОСЛІД 3. Омилення жирів лугом у водному розчині.
У пробірку вносять 0,5-1 г тваринного жиру і добавляють 2-5 мл 15-20% водного розчину їдкого натру. Пробірку переносять на 10-15 хвилин на киплячу… ХІМІЗМ. СH – O – CO – C17H35 CH2OHВИСНОВКИ: Жир нерозчинний у водному розчині лугу і лише поступово емульгується по мірі накопичення у розчині мила; тому омилення жиру відбувається повільно. Продукти омилення жиру - гліцерин і суміш солей жирних кислот (мило) - розчинні у воді, причому мило утворює у воді колоїдний розчин. У розчині кухонної солі мило не розчиняється і виділяється (висолюється) з розчину у вигляді напівтвердої маси.
ДОСЛІД 4. Розчинність та обмінні реакції мила.
А. У дві пробірки поміщають по 0,1-0,2 г мила і додають в одну пробірку 1 мл дистильованої води, а в іншу 6-8 мл дистильованої води. Нагріваючи і… Б. Отриманий розбавлений розчин мила ділять на три частини і додають такий же… У всіх цих випадках рідина над отриманим осадом при збовтуванні майже не утворює піни.ВИСНОВКИ: Натрієві солі вищих жирних кислот добре розчинні у гарячій воді і важче у холодній. Колоїдний характер утворення розчинів визначається за утворенням гелю при охолодженні концентрованих розчинів. Кальцієві, магнієві та свинцеві солі цих кислот менш розчинні у воді і відразу випадають в осад. Унаслідок чого жорстка вода не дає піни з милом.
КОНТРОЛЬНІ ЗАПИТАННЯ І ЗАВДАННЯ
до самостійної роботи
1. Напишіть структурні формули естерів з молекулярною формулою C5H10O2 і назвіть їх.
2. Наведіть коротку характеристику естерів (їх ізомерію, номенклатуру, способи одержання, фізичні та хімічні властивості, окремі представники).
3. Напишіть рівняння хімічних реакцій пропіонового ангідриду з :
а) водою; б) етанолом; в) аміаком.
Назвіть продукти реакції:
4. Що таке мила і миючі засоби? Наведіть їх структурні формули і характеристику.
5. Напишіть рівняння хімічних реакцій і поясніть виникнення рожевого забарвлення у кожному розчині при додаванні кількох крапель розчину фенолфталеїну.
6. Напишіть рівняння хімічних реакцій одержання хлористого ацетилу з оцтової кислоти всіма відомими вам способами.
7. Напишіть рівняння хімічних реакцій одержання ацетаміду:
а) ацилуванням аміаку;
б) з амонійної солі карбонової кислоти;
в) з нітрилу.
8. Які хімічні речовини називають уреїдами і біуретом? Напишіть структурні формули і дайте їм характеристику як хімічних сполук і поясніть їх значення. Що таке біуретова реакція і яке її значення у хімічному аналізі біохімії?
9. Напишіть схему одержання сечовини, наведіть характеристику її властивостей.
10. Наведіть коротку характеристику амідів кислот (їх ізомерії і номенклатури, способів одержання, фізичних і хімічних властивостей окремих представників).
ЛАБОРАТОРНА РОБОТА № 7
ТЕМА: Властивості моноцукридів.
Вуглеводи, органічні сполуки, молекули яких складаються з трьох хімічних елементів — карбону, гідрогену й оксигену у такому кількісному… За хімічними властивостями вуглеводи є альдегідо — і кетоспиртами. За будовою молекули вуглеводи поділяють на дві групи - прості і складні. Прості вуглеводи називають моноцукридами.ХІД РОБОТИ
ДОСЛІД 1. Взаємодія вуглеводів з концентрованими кислотами.
А. У пробірці розчиняють декілька крупинок будь-якого цукру у 1-2 мл води. До холодного розчину обережно, по стінках пробірки, доливають рівний… Б. Невелику кількість глюкози кип'ятять 20-30 с з 2 мл концентрованої…ВИСНОВКИ: при дії концентрованих мінеральних кислот молекули вуглеводів поступово розщеплюються, утворюючи суміш різних продуктів: фурфурол та його похідні, левулинову та мурашину кислоти і так звані гумінові речовини. Гумінові речовини забарвлені у темно-бурий або чорний колір і в умовах досліду виділяються на межі шарів рідини. Гумінові речовини — малоконденсовані, ароматичні сполуки з нез'ясованою структурою молекул, їхні молекули здебільшого мають такий елементний склад: карбон - 50-60%, гідроген - 4-6%, оксиген - 25-40%. Кетози розщепляються кислотами швидше, ніж альдози, пробу Б можна використовувати для швидкого ідентифікування фруктози від глюкози.
ДОСЛІД 2. Виявлення глюкози реакцією Троммера.
У пробірку наливають 2-3 мл 1% розчину глюкози, добавляють 3-5 краплі 10% розчину сульфату купруму (II), 3-4 мл 10% розчину гідроксиду натрію.… ХІМІЗМ. Реакція Троммера відбувається у три окремих етапи. Спочатку… CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4ВИСНОВКИ: Утворення легкорозчинних, інтенсивно забарвлених комплексних алкоголятів з гідроксидом купруму (II) доводить наявність у молекулах цукрів декількох гідроксильних груп, що розташовані поруч. При нагріванні у лужному розчині цукру відновлюють двовалентну мідь, що знаходиться у розчині, самі ж окислюються з утворенням переважно оксикислот. У результаті утворюються і яскраво-забарвлені нерозчинні продукти (гідроксид купруму (І) СuОН, оксид купруму (І) Сu2О або металічна мідь).
Відновлювати сполуки купруму (ІІ) у лужному розчині при нагріванні здатні лише ті цукри, які мають у молекулі вільний гідроксил, тобто моноцукриди. Реакція Троммера використовується як проба, що доводить наявність у розчині редукуючих (відновлюючих) цукрів.
ДОСЛІД 3. Відновлення мідно-тартратного комплексу глюкозою (реакція Фелінга).
У пробірку вносять 1-2 мл 30% розчину їдкого натру і доливають 0,5 мл 2% розчину сульфату купруму. Потім добавляють 2-3 мл 10% розчину сегнетевої… ХІМІЗМ. Спочатку утворюється гідроксид купруму (II). Його іноді називають… CHO COOHВИСНОВКИ: Реактив Фелінга використовується для виявлення моноцукридів у розчинах. Моноцукриди, маючи у складі молекул альдегідну групу, взаємодіють з реактивом Фелінга, відновлюючи його.
ДОСЛІД 4. Відновлення глюкозою аміачного розчину гідроксиду аргентуму (реакція «срібного дзеркала»).
Обладнання та реактиви: 3% розчин нітрату аргентуму, концентрований водний розчин аміаку, 3% розчин глюкози, пробірки, штативи.
Пробірку вимити гарячим розчином лугу і сполоснути дистильованою водою. Внести 1-2 мл 3% розчину нітрату аргентуму і краплями, до повного розчинення, концентрований водний розчин аміаку. Потім до суміші добавляють таку саму кількість 3% розчину глюкози, нагрівають (без струшування) і спостерігають за появою на стінках пробірки блискучого шару металічного срібла або випаданням чорного осаду срібла.
ХІМІЗМ.
AgNO3 + NH4OH → AgOH + NH4NO3
2AgOH → Ag2O + H2O
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]+ OH-
2[Ag(NH3)2]+ OH- +CH2OH – (CHOH)4 – CHO →
глюкоза
→ CH2OH – (CHOH)4 – COOH + 2Ag + 4 NH3 + H2O
глюконова кислота
ВИСНОВОК: Моноцукриди - альдози вступають у реакцію окислення з гідроксидом аргентуму, у результаті чого на стінках пробірки відкладається металічне срібло.
КОНТРОЛЬНІ ЗАПИТАННЯ І ЗАВДАННЯ
до самостійної роботи
1. Які органічні сполуки відносяться до вуглеводів? Що таке моноцукриди?
2. Які функціональні групи визначають хімічну природу моноцукридів: глюкози і фруктози?
3. Реакційна здатність моноцукридів. За допомогою яких реакцій можна довести наявність у молекулі глюкози альдегідної та спиртової груп?
4. За допомогою яких реакцій можна підтвердити належність глюкози до класу багатоатомних спиртів з одного боку, і до альдегідів - з іншого?
5. Написати рівняння реакцій отримання глюконової кислоти та шестиатомного спирту сорбіту з глюкози.
6. Напишіть таутомерні формули право- і лівообертальних ізомерів глюкози, галактози і фруктози.
7. Дайте коротку характеристику основних фізичних властивостей моноцукридів.
8. З яких моноцукридів і за допомогою яких хімічних реакцій добувають глюконову, глюкуронову, цукрову кислоти, сорбіт?
Наведіть рівняння реакцій.
9. Напишіть структурні формули α-метилглюкозиду і β-метилглюкозиду.
10. Як можна добути пентаметилглюкозу і пентаметилгалактозу?
ЛАБОРАТОРНА РОБОТА № 8
ТЕМА: Властивості поліцукридів
Дицукриди - вуглеводи, молекула яких утворена з двох молекул моноцукридів: C6H12O6 + C6H12O6 → C12H22O11 + H2O Д-глюкоза Д-фруктоза цукрозаХІД РОБОТИ
ДОСЛІД 1. Гідроліз (інверсія) цукрози.
У пробірку наливають 2-5 мл 10% розчину цукрози, добавляють 1 мл 10% розчину сульфатної кислоти. Збовтують і кип'ятять 3-6 хвилин. Добутий розчин… ХІМІЗМ.ВИСНОВКИ: Інверсія - зміна знака обертання площини поляризації світла у поляриметрії розчину цукрози після її гідролізу. До гідролізу розчин цукрози обертає площину поляризації світла у поляриметрії праворуч на кут + 66,53º.Після гідролізу молекула цукрози розщепляється на дві речовини — α-Д(+) - глюкозу і α-Д(-) - фруктозу. Перша з них є праворучобертальною гексозою (+52,5°), друга — ліворучобертальною (-93°).
ДОСЛІД 2. Реакції крохмалю.
Біля 1 г крохмалю збовтують у 5-6 мл води, суміш відстоюють 1-2 хвилини, зливають воду і промивають крохмаль ще 2-3 рази новими порціями води.… Охолоджують розчин і проводять з ним наступні реакції. А). До 1-2 мл розчину крохмалю додають краплю розчину йоду. Отриману темно-синю рідину нагрівають. Забарвлення зникає.…ВИСНОВКИ: Крохмаль містить два поліцукриди - амілозу й амілопектин, молекули яких побудовані із залишків дицукриду мальтози. В амілозі залишки мальтози сполучені у вигляді ланцюжка, а в амілопектині вони розташовані більш складно. У холодній воді крохмаль не розчиняється, у гарячій воді утворює колоїдний розчин - клейстер. При дії йоду амілоза забарвлюється у синій колір, а амілопектин - у синьо-фіолетовий. Причиною появи забарвлення вважають утворення молекулярних сполук йоду з амілозою й амілопектином. В амілозі ланцюг циклічних залишків глюкози розташований у просторі спіральне і молекули йоду розміщуються у порожнині циліндру у співвідношенні: одна молекула йоду на один залишок глюкози. Сполука має вигляд С6H10О5I2. У довгих молекулах амілози і амілопектину вільні глюкозидні гідроксильні групи розташовані лише на кінцях ланцюга, тобто їх число у молекулі мале. Тому крохмаль не дає чітких реакцій ні з лугом, ні з солями міді.
ДОСЛІД 3. Ступінчастий гідроліз крохмалю.
У пробірку наливають 9 мл 1% розчину крохмального клейстеру і добавляють 1 мл концентрованої хлоридної кислоти. Вміст пробірки перемішують і… ХІМІЗМ. У процесі гідролізу молекула крохмалю поступово розщеплюється через ряд проміжних продуктів (декстринів, мальтози) до…ВИСНОВКИ: Про наявність процесу гідролізу свідчить поява відповідних цукрів. У перших п'яти пробірках виразна реакція Троммера спостерігається у четвертій пробірці, де є мальтоза, і у п'ятій пробірці, де утворилася глюкоза. В інших п'яти пробірках залежно від ступеня гідролізу спостерігається гама забарвлень: у першій пробірці — синьо-фіолетове (містяться амілодекстрини і крохмаль), у другій — червоно-буре (еритродекстрини), у третій — оранжеве (ахро- і мальтозодекстрини), у четвертій - оранжево-жовте (мальтозодекстрини і мальтоза), у п'ятій - жовте і світло-жовте забарвлення (мальтоза і глюкоза).
ДОСЛІД 4. Взаємодія целюлози з лугом.
Встановлюють у штативі дві пробірки. Одну заповнюють водою, іншу - концентрованим розчином лугу. З фільтрованого паперу вирізають дві однакові… Вийнявши смужку паперу з води, віджимають її у фільтрованому папері і…ВИСНОВКИ: Луг у концентрованому розчині поглинається целюлозою і частково зв'язується нею. При цьому целюлоза набухає, її волокна потовщуються та вкорочуються.
КОНТРОЛЬНІ ЗАПИТАННЯ І ЗАВДАННЯ
До самостійної роботи
2. Цукроза - дисахарид. Які моноцукриди входять до складу цукрози? 3. Крохмаль та целюлоза - представники групи полісахаридів. Який характер… 4. Здійснити перетворення:– Конец работы –
Используемые теги: органічної, хімії0.045
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: З органічної хімії
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов