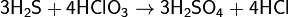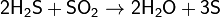Химические свойства
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
 Ka = 6.9·10−7 моль/л; pKa = 6.89.
Ka = 6.9·10−7 моль/л; pKa = 6.89.
Реагирует со щелочами:
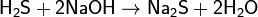 (обычная соль, при избытке NaOH)
(обычная соль, при избытке NaOH)
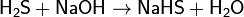 (кислая соль, при отношении 1:1)
(кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. На воздухе горит синим пламенем:
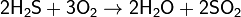
при недостатке кислорода:
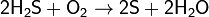 (на этой реакции основан промышленный способ получения серы).
(на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO42−, например: