Гидролиз солей
Гидролизом солей называют реакции ионного обмена между молекулами растворенной соли и молекулами воды с образованием слабого электролита (т.е. молекул или ионов слабого электролита).
Студентам рекомендуется основательно проработать по учебным пособиям соответствующие параграфы и приобрести навыки для записи процессов гидролиза солей по шагам:
1. Составить уравнение электролитической диссоциации соли.
2. Определить, по какому из ионов идет гидролиз соли. Гидролиз идет по иону, образованному из слабого электролита. Список сильных кислот и оснований приведен выше (см. раздел «Кислоты и основания.
3. Написать для выбранного иона уравнение взаимодействия с одной молекулой воды. Данное уравнение и будет главной записью гидролиза соли – сокращенным ионным уравнением гидролиза. Уравнение демонстрирует наступившее в растворе равновесие и характеризуется собственной константой равновесия – константой гидролиза (КГ.). На этом этапе возможно определить характер среды, возникающей в растворе – создается: либо кислая, либо щелочная реакция среды. В случае, когда соль образована слабой кислотой и слабым основанием, реакция среды будет близкой к нейтральной (т.е. pН ≈ 7).
4. Написать уравнение гидролиза в молекулярном виде. При этом за основу берется ионное уравнение, а для составления молекул используются ионы противоположного знака (противоионы) из уравнения диссоциации соли (см. шаг 1).
Пример.Составить уравнение гидролиза хлорида меди (II).
1. Диссоциация соли: CuCl2 = Cu2+ + 2Cl–.
2. Известно, что катиону Cu2+ соответствует слабое основание, а иону Cl– – сильная кислота. Таким образом, гидролиз идет по катиону.
3. Уравнение гидролиза: Cu2+ + HOH ↔ (CuOH)+ + H+. Закономерно, что положительный катион Cu2+ притягивает к себе из молекулы воды отрицательную частицу OH– и образуется составной катион с зарядом +1. Связывание катионом Cu2+ частиц OH– приводит к накоплению в растворе избытка ионов H+ и, следовательно, в результате гидролиза в растворе создается кислая среда.
Осталось записать выражение для константы гидролиза:
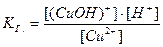 .
.
4. При составлении уравнения в молекулярной форме, надо увидеть, что всем положительным ионам соответствуют имеющиеся в растворе в свободном виде отрицательные ионы Cl–. С учетом зарядов ионов составляем электронейтральные молекулы и подбираем коэффициенты:
CuCl2 + HOH ↔ Cu(OH)Cl + HCl.