рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- ХИМИЯ По изучению дисциплины и задания для контрольных работ
Реферат Курсовая Конспект
ХИМИЯ По изучению дисциплины и задания для контрольных работ
ХИМИЯ По изучению дисциплины и задания для контрольных работ - раздел Химия, ...

МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РФ
Кафедра неорганической химии
Х И М И Я
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по изучению дисциплины и задания
для контрольных работ
студентам заочного отделения
по инженерным специальностям
САНКТ-ПЕТЕРБУРГ
2 0 1 0
Методические рекомендации рассмотрены и одобрены учебно-методической комиссией факультета почвоведения и агроэкологии СПбГАУ. Протокол № 6 от 15 июня 2010 г.
С о с т а в и т е л и: доцент Б.П. Титов
доцент В.В. Порсев
доцент А.П. Агапова
ВВЕДЕНИЕ
В настоящее время в России одним из приоритетных национальных проектов по модернизации страны признана коренная перестройка сельскохозяйственного производства. Одним из важнейших этапов решения данной задачи является создание прочной материальной базы АПК.
И руководство страны, и руководство АПК стремятся модернизировать и развивать продовольственную отрасль экономики. Это предполагает: увеличение объемов производимой сельхозпродукции (при обеспечении ее необходимого качества), технологическое перевооружение перерабатывающих комплексов, ориентация производств АПК на научно обоснованные нормы потребления, а также внедрение новейших индустриальных технологий на всех участках функционирования АПК.
Усваивая общетеоретический материал, студент приобретает тот минимальный запас знаний, который понадобится ему и в будущей профессии, и при изучении специальных дисциплин на последующих курсах обучения по избранной специальности.
ОБЩИЕ МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ИЗУЧЕНИЮ ДИСЦИПЛИНЫ
Каждый студент выполняет одну контрольную работу и доставляет (или высылает по почте) в деканат заочного отделения, что является основанием для… Оформление контрольной работы должно быть выполнено аккуратно и разборчиво.… Условия заданий переписываются полностью с указанием номера задачи в соответствии с методическими рекомендациями.ВОССТАНОВИТЕЛЬНАЯ ЧАСТЬ
Основные понятия химии
Атом – частица вещества, состоящая из положительного заряженного ядра и отрицательно заряженных электронов.
Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Химические свойства молекул определяются их составом и химическим строением.
Химический элемент – определенный вид атомов с одинаковым зарядом ядра.
Простые вещества – вещества, образованные из атомов одного элемента. Например: N2, O2, Cl2, P4, S8 и т.п.
Сложные вещества, или химические соединения – вещества, образованные атомами разных элементов. Например: NH3; Ca(H2PO4)2; MgCl2; KNO3 и т.п.
Относительная атомная масса химического элемента – отношение средней массы атома естественного изотопического состава элемента к 1/12 массы атома изотопа углерода 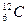 . Относительные атомные массы элементов обозначают Ar, где индекс«r» – начальная буква английского слова relative (относительный).
. Относительные атомные массы элементов обозначают Ar, где индекс«r» – начальная буква английского слова relative (относительный).
Записи Ar(H), Ar(O), Ar(C) означают относительные массы водорода, кислорода и углерода соответственно.
Вместо термина «относительная атомная масса» можно использовать исторически сложившийся термин «атомная масса».
Относительная молекулярная масса (Мr) равна отношению средней массы молекулы естественного изотопического состава к 1/12 массы изотопа углерода 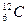 .
.
Относительная молекулярная масса равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества. Она легко высчитывается по формуле вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома 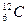 (т.е. атомной единицы массы, которая численно равна 1,66∙10-24 г).
(т.е. атомной единицы массы, которая численно равна 1,66∙10-24 г).
Моль – это единица количества вещества, принятая в международной системе единиц (СИ).
Один моль содержит, столько структурных единиц (молекул, атомов, ионов или других частиц), сколько атомов содержит 12 гизотопа углерода 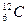 .
.
Зная массу одного атома углерода (1,999∙10-23 г), можно легко вычислить число атомов (NA)в 12 г углерода.
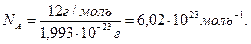
Это число называется постоянной Авогадро.
Единица количества (моль) обозначается «n».
Молярная масса вещества – это величина, равная отношению массы вещества (m) к количеству вещества:
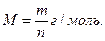
Химические знаки, формулы и уравнения
Состав сложных веществ изображают при помощи химических формул: H2SO4; FeCl3 и т.п. Подстрочными индексами обозначают число атомов данного типа в… Химические уравнения записывают при помощи химических формул и знаков: FeCl3 + 3NaOH = Fe(OH)3+3NaCl.Основные законы химии
2. Закон постоянства состава вещества Всякое химически чистое вещество молекулярной структуры всегда имеет постоянный качественный и количественный… 3. Закон Авогадро В равных объемах различных газов при одинаковых условиях… 4. Закон эквивалентов Вещества, вступающие в химические реакции, реагируют между собой в количествах, прямо…ЗАДАНИЯ И МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ВЫПОЛНЕНИЮ КОНТРОЛЬНОЙ РАБОТЫ
Важнейшие классы неорганических соединений
Перед выполнением заданий по данному разделу, студент должен запомнить, что свойства химических соединений определяются, прежде всего, их составом, поэтому необходимо освоить навыки составления формул соединений различных классов. Основным принципом при составлении формул молекул является подбор таких соотношений атомов или атомных групп в молекулах, чтобы обеспечить электронейтральность молекулы.
Важнейшими классами неорганических соединений являются оксиды, основания, кислоты и соли.
A) Оксиды
Примеры. СаН2 – гидрид кальция, Al2S3 – сульфид алюминия,Контрольные задания
1. Определить все возможные оксиды для всех элементов своего варианта задания, приведенного в табл. 1.
2. Отметить, какие из оксидов относятся к основным, амфотерным, кислотным.
3. Составить уравнения реакций кислотных и амфотерных оксидов с К2О и NaOH.
5. Составить уравнения реакций основных и амфотерных оксидов с SO3 и HNO3.
Т а б л и ц а 1
| номер задания | элементы (для элементов с переменными степенями окисления следует составить все возможные формулы оксидов) |
| Хром, цезий, фосфор, мышьяк | |
| Бром, алюминий, кальций, рубидий | |
| Бериллий, калий, хлор, медь | |
| Свинец, железо, сера, фосфор | |
| Литий, барий, свинец, теллур | |
| Марганец, фосфор, углерод, калий | |
| Натрий, йод, хром, литий | |
| Марганец, калий, углерод, магний | |
| Литий, барий, железо, олово | |
| Бор, хлор, ванадий, кальций |
Пример.Элементы задания: цинк, селен, кобальт, цезий.
По таблицам определяем возможные степени окисления элементов: Zn(2+), Se(4+), Se(6+), Со(2+), Со(3+), Cs(+1).
Определяем формулы оксидов на основании правил, приведенных выше: ZnO, SeО2, SeО3, CoO, Со2О3 и Cs2O. Распределяем по группам:
· Кислотные: SeO2, SeО3;
· Основные: CoO, Со2O3, Cs2O;
· Амфотерные: ZnO.
Таким образом, с К2О и NaOH могут взаимодействовать SeO2, SеО3 и ZnO, а с SO3 и HNO3 – CoO, Co2O3, Cs2O и ZnO.
Напишем уравнения реакций, не забыв уравнять количество атомов до и после реакции:
К2О + SeO2 = K2SeO3,
К2О + SeO3 = K2SeO4,
К2О + ZnO = K2ZnO2,
2NaOH + SeO2 = Na2SeO3 + H2O,
2NaOH + SeO3 = Na2SeO4 + H2O,
2NaOH + ZnO = Na2ZnO2 + H2O,
SO3 + CoO = CoSO4,
3SO3 + Со 2O3 = Co2(SO4)3,
SO3 + Cs2O = Cs2SO4,
SO3 + ZnO = ZnSO4,
2HNO3 + CoO = Co(NO3)2 + H2O,
6HNO3 + Co2O3 = 2Co(NO3)3 + 3H2O,
2HNO3 + Cs2O = 2CsNO3 + H2O,
2HNO3 + ZnO = Zn(NO3)2 + H2O.
Для того чтобы составить формулу образующейся соли, необходимо знать формулу кислоты, соответствующей оксиду. Для ее нахождения необходимо ФОРМАЛЬНО прибавить молекулу воды к формуле кислотного или амфотерного оксида, в случае необходимости сократив число атомов до простейшей формулы:
Н2О + SеО3 = H2SeO4, то есть оксиду селена (VI) соответствует селеновая кислота H2SeO4, анион которой имеет формулу SeO42– и заряд (2–).
Н2О + ZnO = H2ZnO2, то есть оксиду цинка ФОРМАЛЬНО соответствует кислота H2ZnO2, анион которой имеет формулу ZnO22– и заряд (2–).
Н2О + N2O5 = H2N2O6, сокращая на два, получим формулу азотной кислоты HNO3, соответствующей оксиду азота (V).
B) Кислоты и основания
Кислоты классифицируются: · По составу (кислородсодержащие, бескислородные). Например: HNO3 и НС1. · По основности (одно-, двух-, трехосновные). Например: HNO3, H2SO4 и Н3РО4.Контрольные задания
1. Составить уравнения ступенчатой диссоциации соединений в своем варианте задания, приведенного в табл.2.
2. Составить уравнения реакций кислот и амфотерных гидроксидов с BaО и NaOH.
3. Составить уравнения реакций основных и амфотерных гидроксидов с SO3 и HNO3.
Т а б л и ц а 2
| номер задания | формулы кислот и гидроксидов | ||
| HCI | Zn(OH)2 | CsOH | |
| Ве(ОН)2 | H2SeO4 | Ni(OH)2 | |
| LiOH | H2SO3 | Al(ОН)з | |
| HNO2 | Pb(OH)2 | Са(ОН)2 | |
| Ва(ОН)2 | H3BO3 | Sn(OH)2 | |
| RbOH | H2CO3 | Ве(ОН)2 | |
| Аl(ОН)3 | НВrOз | Со(ОН)2 | |
| Sr(OH)2 | HNO2 | Рb(ОН)2 | |
| Cr(OH)3 | H2S | LiOH | |
| H2SiO3 | A1(OH)3 | КОН |
Пример. Вещества задания: HBrO4, Mn(OH)2, Cr(OH)3.
Поскольку основные и амфотерные гидроксиды записываются одинаково, не всегда ясно к какому классу принадлежит тот или иной гидроксид. Для установления класса гидроксида металла руководствуются тем фактом, что характер его такой же, как у оксида этого металла той же степени окисления. В нашем случае Мn(OН)2 соответствует оксид МnО (с.о. = +2), который по правилам, определенным ранее, является основным. Cr(OH)3 соответствует оксид Cr2O3 (с.о. = +3), который является амфотерным. Таким образом, и с кислотой, и с основанием будет взаимодействовать Cr(OH)3.
Напишем уравнение диссоциации кислоты. Поскольку бромная кислота одноосновна, диссоциация проходит в одну стадию:
НBrО4 = Н+ + BrО4–.
Диссоциация основания будет происходить следующим образом (в данном случае диссоциация идет в две ступени, поскольку гидроксид марганца двухкислотен):
Мn(ОН)2 ↔ МnОН+ + ОН– ,
МnОН+ ↔ Мn2+ + ОН–.
Диссоциация амфотерного гидроксида по основному типу:
Cr(OH)3 ↔ Cr(OH)2+ + ОН–,
Cr(OH)2+ ↔ Cr(OH)2+ + ОН–,
C(rOH)2+ ↔ Cr3+ + OH–.
Напишем уравнения реакций кислоты и амфотерного гидроксида с К2О и NaOH, не забыв уравнять количество атомов до и после реакции:
2НBrО4 + К2О = 2КBrО4 + Н2О,
НBrО4 + NaOH = NaBrO4 + Н2О,
2Cr(OH)3 + К2О = 2KCrO2 + ЗН2О,
Cr(OH)3 + NaOH = NaCrO2 + 2H2O.
Напишем уравнения реакций основания и амфотерного гидроксида с SO3 и HNO3, не забыв уравнять количество атомов до и после реакции:
Mn(OH)2 + SO3 = MnSO4 + Н2О,
2Cr(OH)3 + 3SO3 = Cr2(SO4)3 + 3H2O,
Mn(OH)2 + 2HNO3 = Mn(NO3)2 + 2H2O,
Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O.
C) Соли
Нормальные (средние) соли образуются при полном замещении ионов водорода. Кислые или основные соли образуются при неполном замещении – ионов… При составлении формулы соли необходимо соблюдать условие… Не нужно отдельно вычислять степени окисления каждого из элементов в кислотном остатке, поскольку для правильного…Контрольные задания
1. Составить уравнения реакций образования всех солей, возможных при реакции кислоты и основания, указанных в задании во втором столбце табл. 3. Назвать соли. Написать уравнения диссоциации полученных солей.
2. По названию (столбец 3 табл. 3) составить формулы солей. Написать реакции получения солей из исходных гидроксида и кислоты.
Т а б л и ц а 3
| номер задания | кислоты и гидроксиды | названия солей |
| Zn(OH)2, H2SO4 | гидроортофосфат натрия, бромид дигидроксожелеза (III) | |
| Са(ОН)2, Н2СО3 | хлорат гидроксомагния, гидросульфат алюминия | |
| А1(ОН)3, HNO3 | карбонат гидроксомеди (II), гидросульфит кальция | |
| Fe(OH)3, HCl | гидросульфид натрия, нитрат дигидроксохрома (III) | |
| КОН, H3AsO4 | гипохлорит гидроксокальция, дигидроотофосфат калия | |
| NaOH, H3BO3 | хлорид гидроксоцинка, гидросиликат натрия | |
| Ва(ОН)2, H2S | гидроортоарсенат аммония, ортоборат гидроксобария | |
| Sr(OH)2, H2SO3 | нитрат гидроксоалюминия, гидросульфат марганца (II) | |
| Cr(OH)3, HBr | гидроортоборат калия, нитрит гидроксокальция | |
| RbOH, H3PO4 | хлорид гидроксоникеля (II), гидросульфит магния |
Пример 1. кислота и гидроксид: Со(ОН)2 и H2SeO4.
Для написания формул всех возможных солей необходимо составить формулы всех возможных катионов и анионов, которые легко получить, выписав уравнения ступенчатой диссоциации для соединений задания:
Со(ОН)2 ↔ СоОН+ + ОН–;
СоОН+ ↔ Со2+ + ОН–;
H2SeО4 = H+ + HSeО4– ;
HSeO4- = H+ + SeО42–.
Таким образом, соли могут быть образованы следующими ионами: СоОН+, Со+, HSeO4– и SeО42–. Составим соли, не забывая соблюдать условие электронейтральности: (CoOH)2SeO4, CoSeO4, Co(HSeO4)2.
Обратите внимание, что образование соли из катиона СоОН+ и аниона HSeO4 НЕВОЗМОЖНО, так как в этом случае частицы ОН- и Н+ «встретятся» в формуле соли, что приведет к образованию Н2О и средней соли CoSeO4! Названия солей (название аниона см. приложение):
CoSeО4 – селенат кобальта (II) (средняя соль),
(CoOH)2SeO4 – селенат гидроксокобальта (II) (основная),
Co(HSeO4)2 – гидроселенат кобальта (II) (кислая).
Диссоциация солей, как уже упоминалось, происходит полностью. Запишем уравнения диссоциации:
CoSeO4 → Со2+ + SeO42–,
(CoOH)2SeO4 → 2CoOH+ + SeO42–,
Co(HSeO4)2 → Со2+ + 2HSeO4–.
Пример 2. Названия солей: гидрокарбонат кальция, сульфат гидроксомагния.
Карбонат – соль угольной кислоты (Н2СО3), формула аниона: СО32–. Приставка «гидро-» означает, что один ион водорода остается соединенным с анионом, то есть ион гидрокарбоната – НСО3–. Таким образом, формула соли: Са(НСО3)2. Как уже упоминалось, исходной кислотой для данной соли будет угольная (Н2СО3). Исходным основанием – гидроксид металла, в данном случае гидроксид кальция, то есть Са(ОН)2. Реакция образования соли выглядит следующим образом:
Са(ОН)2 + 2Н2СО3 = Са(НСО3)2 + 2Н2О.
Аналогично рассмотрим следующую соль, сульфат гидроксомагния. Сульфат – соль серной кислоты (H2SO4), формула ее аниона: SO42–. Приставка «гидроксо-» означает, что с ионом Mg2+ остается связана одна группа ОН– , то есть гидроксид магния Mg(OH)2, являющийся исходным основанием для образования соли, отдает при образовании соли только одну группу ОН– и остается в виде MgOH+. Таким образом, формула соли – (MgOH)2SO4. Реакция образования соли:
2Mg(OH)2 + H2SO4 = (MgOH)2SO4 + 2Н2О.
Способы выражения концентраций растворов
· Какие системы называются растворами? · Водные растворы и их значение в технике. · Взаимодействие веществ в растворах.Контрольные задания
По исходным данным табл. 4 выразить (рассчитав) следующие виды концентраций (каждый из студентов по своему веществу и по своим конкретным показателям m(H2O); m(вещества); d(раствора)):
a) процентную концентрацию (С%);
b) молярную концентрацию (СM);
c) моляльную концентрацию (Сm);
d) титр (Т).
Т а б л и ц а 4
| номер задания | m(H2O), г | m(в-ва), (г) | d(р-ра), г/см3 | растворенное вещество |
| 1,10 | Cr2(SO4)3 | |||
| 1,08 | CaCl2 | |||
| 1,05 | Na3PO4 | |||
| 1,15 | Al(NO3)3 | |||
| 1,22 | FeSO4 | |||
| 1,10 | BaCl2 | |||
| 1,07 | AlCl3 | |||
| 1,35 | Mg(NO3)2 | |||
| 1,10 | Cu(CH3COO)2 | |||
| 1,12 | Fe2(SO4)3 | |||
| 1,20 | Ba(NO3)2 | |||
| 1,16 | Cd(NO3)2 | |||
| 1,08 | FeCl3 | |||
| 1,06 | ZnSO4 | |||
| 1,09 | Al2(SO4)3 | |||
| 1,18 | Hg(NO3)2 | |||
| 1,09 | CrCl3 | |||
| 1,04 | Na2SO4 | |||
| 1,14 | Ni2(SO4)3 | |||
| 1,12 | (NH4)2SO4 |
Энергетика химических реакций
Термодинамикой называется наука о взаимных превращениях энергии из одной формы в другую. Важнейшими законами являются первый и второй законы… Раздел химической термодинамики, который занимается изучением тепловых явлений… В термохимических уравнениях рядом с формулами различных веществ следует записывать агрегатное состояние реагента (или…Контрольные задания
51. Реакция горения бензола выражается схемой:
С6Н6(ж.) + О2(г.) → СО2(г.) + Н2О(ж.).
Вычислить энтальпию данной реакции (предварительно уравняв), если известно, что энтальпия парообразования С6Н6 ΔHºпар.(С6Н6) = +33,9 кДж/моль, а энтальпии образования СО2(г.) и Н2О(ж.) равны соответственно: –393,51 кДж/моль и –285,84 кДж/моль.
52. Рассчитать энтальпию реакции горения этилового спирта С2Н5ОН(г.), если стандартные энтальпии образования для С2Н5ОН(ж.), Н2О(г.) и СО2(г.) равны соответственно: –235,31 кДж/моль; –241,83 кДж/моль; и –393,51 кДж/моль.
53. Вычислить энтальпию процесса и записать термохимическое уравнение реакции горения этана, в результате которой получаются пары воды и СО2(г.), если:
ΔНºобр.(Н2О(г.)) = –241,83 кДж/моль,
ΔНºобр.(СО2(г.)) = –393,51 кДж/моль,
ΔНºобр.(C2H6(г.)) = –89,7 кДж/моль.
54. Тепловой эффект реакции сгорания жидкого бензола с образованием Н2О(г.) и СО2(г.) равен ΔHх.р. = –3135,58 кДж. Составить термохимическое уравнение данной реакции и вычислить стандартную энтальпию образования С6Н6(ж.), если:
ΔНºобр.(Н2О(г.)) = –241,83 кДж/моль,
ΔНºобр.(СО2(г.)) = –393,51 кДж/моль.
55. Вычислить энтальпию сгорания 112 литров (при н.у.) этилена (продукты сгорания СО2(г) и Н2О (г.)), если:
ΔНºобр.(С2Н4(г.)) = 52,28 кДж/моль,
ΔНºобр.(СО2(г.)) = –393,51 кДж/моль,
ΔНºобр.(Н2О(г.)) = –241,83 кДж/моль.
56. Рассчитать стандартную энтальпию образования РН3(г.), исходя из уравнения:
2РН3(г.) + 4О2(г.) = Р2О5(тв.) + 3Н2О(ж.),
ΔНх.р. = –2360 кДж,
ΔНºобр.(Р2О5(тв.)) = –1492 кДж/моль,
ΔНºобр.(Н2О(ж.)) = –285,84 кДж/моль.
57. Сожжены равные объемы Н2 и С2Н2, взятые при одинаковых условиях. В каком случае и во сколько раз больше выделится тепла (сгорание считать полным)?
ΔНºобр.(С2Н2(г.)) = 226,8 кДж/моль,
ΔНºобр.(Н2О(г.)) = –241,8 кДж/моль,
ΔНºобр.(СО2(г.)) = –393,5 кДж/моль.
58. Окисление глюкозы в организме может протекать по схеме:
С6Н12О6(кр.) + О2(г.) → СО2(г.) + Н2О(ж.).
Уравнять реакцию и рассчитать, сколько энергии получает организм при потреблении 18 г глюкозы.
ΔНºобр.(С6Н12О6(кр.)) = –1273 кДж/моль,
ΔНºобр.(Н2О(ж.)) = –285,8 кДж/моль,
ΔНºобр.(СО2(г.)) = –393,5 кДж/моль.
59. При взаимодействии газообразных Н2 и СО2 образуются Н2О(г.) и СO(г.). Записать термохимическое уравнение и рассчитать энтальпию реакции, если:
ΔНºобр.(СО2(г.)) = –393,5 кДж/моль,
ΔНºобр.(СO(г.)) = –110,5 кДж/моль,
ΔНºобр.(Н2О(г.)) = –241,8 кДж/моль.
60. Вычислить энтальпию реакции, если при восстановлении Fe2O3 металлическим Al, если было получено 150 граммов железа.
ΔНºобр.(Al2O3(тв.)) = –1669,8 кДж/моль,
ΔНºобр.(Fe2O3(тв.)) = –882,10 кДж/моль.
61-70. На основании значений стандартных энтальпий образования и абсолютных стандартных энтропий веществ вычислить величину ΔGх.р. и сделать вывод о самопроизвольности протекания заданной реакции в стандартных условиях. Если в задании даны значения ΔGºобр., то ΔGх.р. рассчитывается непосредственно, не используя формулу Гиббса. Во всех заданиях значения ΔНºобр. и ΔGºобр. заданы в кДж/моль, а значения Sºабс. – в Дж/моль·К. Реакции необходимо предварительно уравнять.
61. NH3(г.) + HCl(г.) → NH4Cl(кр.)
ΔНºобр.: –46,19 –91,31 –315,39
Sºабс.: 192,5 186,68 94,5
62. NH3(г.) + О2 (г.) → NO(г.) + Н2О(г.)
ΔНºобр.: –46,19 90,37 –241,83
Sºабс.: 192,5 205,03 210,20 188,72
63. Fe3O4(кр.) + CO(г.) → FeO(кр.) + CO2(г.)
ΔGºобр.: –1014,2 –137,27 –244,3 –394,38
64. PbO2(кр.) + Zn(кр.) → Pb(кр.) + ZnO(кр.)
ΔGºобр.: –276,6 –350,6
65. СО2(г.) + Н2(г.) → СH4(г.) + Н2О(г.)
ΔНºобр.: –393,51 –74,85 –241,83
Sºабс.: 213,65 130,59 186,19 188,72
66. TiO2(кр.)+ C(графит) → Ti(кр.) + CO(г.)
ΔНºобр.: –943,9 –110,5
Sºабс.: 50,3 5,69 30,7 197,91
67. С2Н4(г.) + О2(г.) → СО2(г.) + Н2О(ж.)
ΔНºобр.: 52,28 –393,51 –285,84
Sºабс.: 219,45 205,03 213,65 70,1
68. НСl(г.) + O2(г.) → Сl2(г.) + Н2О(ж.)
ΔGºобр.: –92,5 –237,3
69. Al(кр.) + Fe3O4(кр.) → Fe(кр.) + Al2O3(кр.)
ΔGºобр.: –1014,2 –1582,0
70. СН3ОН(ж.) + O2(г.) → Н2О(г.) + СО2(г.)
ΔНºобр.: –201,17 –241,83 –393,51
Sºабс.: 126,8 205,03 188,72 213,65
Химическая кинетика и химическое равновесие
Скорость химической реакции в каждый момент времени выражается пропорциональна концентрациям реагентов, возведённым в некоторые степени (закон… Пример 1.Во сколько раз изменится скорость прямой и обратной реакций в… 2SO2(г.) + O2(г.) ↔ 2SO3(г.),Контрольные задания
1. Рассчитать изменение скорости реакции при изменении концентраций реагентов. Изменения концентраций даны в таблице 5.
2. Рассчитать изменение скорости реакции при изменении температуры. Интервалы температур и температурные коэффициенты γ приведены в таблице 5.
Реакции необходимо предварительно уравнять.
Т а б л и ц а 5
| номер задания | реакция | а) | б) | γ | ΔtºC | |
| от | до | |||||
| H2(г.) + O2(г.) → H2O(г.) | ||||||
| A(г)+B(г)→A2B(г) | ||||||
| HN3(г.) + NO(г.) → H2O2(ж.) + N2(г.) | ||||||
| H2(г.) + I2(г.) → HI(г.) | ||||||
| SO2(г.) + O2(г.) → SO3(г.) | ||||||
| B2H6(г.) + Cl2(г.) → BCl3(г.) + HCl(г.) | ||||||
| NO(г.) + Br2(г.) → NOBr(г.) | ||||||
| CO2(г.) + H2(г.) → CH4(г.) + H2O(г.) | ||||||
| SiH4(г.) + H2O(г.) → H2(г.) + SiO2(тв.) | ||||||
| N2(г.) + H2(г.) → NH3(г.) |
а) – увеличение концентрации первого реагента в … раз.
б) – уменьшение концентрации второго реагента в … раз.
Реакции ионного обмена в растворах электролитов
Поэтому в растворах электролитов уравнения реакций записывают в форме ионно-молекулярных уравнений. В таких уравнениях сильные электролиты (так как… В сокращенном ионно-молекулярном уравнении одинаковые ионы с обеих сторон… H2SO4 + 2KOH = K2SO4 + H2O,Контрольные задания
81-90. Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия между водными растворами веществ своего задания в таблице 6.
Т а б л и ц а 6
| номер задания | реакция 1 | реакция 2 | реакция 2 |
| KOH и Be(OH)2 | HNO3 и Mn(OH)2 | HCl и AgNO3 | |
| AgNO3 и Na3PO4 | NaI и Pb(NO3)2 | K2S и CdSO4 | |
| Pb(OH)2 и HCl | NaOH и BeSO4 | NH4Cl и Ca(OH)2 | |
| K2CO3 и H2SO4 | FeCl2 и NaOH | H2SO4 и Ca(OH)2 | |
| FeCl3 и NH4OH | ZnCl2 и H2S | Na2CO3 и HNO3 | |
| MgCO3 и HNO3 | Na2S и H2SO4 | KNO2 и HCl | |
| K2SiO3 и HCl | Ca(OH)2 и (NH4)2S | CaCl2 и AgNO3 | |
| CuSO4 и H2S | BaCO3 и HNO3 | FeCl3 и NaOH | |
| Al(OH)3 и KOH | Cr(OH)3 и KOH | Na2SiO3 и HNO3 | |
| Na2CO3 и H2SO4 | Zn(OH)2 и NaOH | CuSO4 и Na2S |
91-100. Составьте молекулярные уравненияреакций, которым соответствуют следующие ионно-молекулярные уравнения в таблице 7.
Т а б л и ц а 7
| номер задания | реакция 1 | реакция 2 |
| H+ + OH– = H2O | Pb2+ + S2– = PbS | |
| ClO– + H+ = HClO | Hg2+ + 2OH– = Hg(OH)2 | |
| 2H+ + SiO32– = H2SiO3 | Pb2+ + 2I– = PbI | |
| H+ + NO2– = HNO2 | Al3+ + PO43– = AlPO4 | |
| Ag+ + I– = AgI | Ba2+ + SO42– = BaSO4 | |
| Cd2+ + 2OH– = Cd(OH)2 | Ag+ + Cl– = AgCl | |
| Mg2+ + CO32– = MgCO3 | SiO32– + 2H+ = H2SiO3 | |
| NO2– + H+ = HNO2 | Cd2+ + S2– = CdS | |
| CO32– + 2H+ = H2O + CO2 | Fe3+ + 3OH– = Fe(OH)3 | |
| Ni2+ + S2– = NiS | 3Li+ + PO43– = Li3PO4 |
Гидролиз солей
Студентам рекомендуется основательно проработать по учебным пособиям соответствующие параграфы и приобрести навыки для записи процессов гидролиза… 1. Составить уравнение электролитической диссоциации соли. 2. Определить, по какому из ионов идет гидролиз соли. Гидролиз идет по иону, образованному из слабого электролита.…Контрольные задания.
Составьте ионные и молекулярные уравнения гидролиза солей, приведенных в вашем задании, а также напишите выражения для констант гидролиза.
101. Хлорид алюминия, сульфид калия.
102. Нитрат меди (II), карбонат натрия.
103. Сульфат железа (II), силикат натрия.
104. Хлорид никеля (II), сульфит калия.
105. Сульфат аммония, ортоборат натрия.
106. Хлорид цинка, сульфид бария.
107. Нитрат свинца (II), цианид калия.
108. Нитрат алюминия, ацетат калия.
109. Хлорид марганца (II), ортофосфат калия.
110. Бромид железа (III), гипохлорит натрия.
111. Хлорид хрома (III), сульфид кальция.
112. Нитрат свинца (II), карбонат калия.
113. Сульфат алюминия, ортоборат натрия.
114. Нитрат никеля (II), силикат натрия.
115. Иодид железа (II), ацетат кальция.
116. Сульфат цинка, сульфид натрия.
117. Хлорид цинка, ортофосфат калия.
118. Бромид свинца (II), карбонат натрия.
119. Сульфат олова (II), силикат калия.
120. Йодид марганца (II), гипохлорит кальция.
Окислительно-восстановительные реакции
Большинство степеней окисления элементов представлены в параграфе «Основные классы неорганических соединений». Следует помнить, что с.о. простых… ОВР – единый взаимосвязанный процесс. Окисление какого-либо элемента приводит… В ходе ОВР элемент-окислитель принимает электроны (акцептор электронов), а элемент-восстановитель отдает электроны…Контрольные задания
Составить уравнения ОВР, идущих по схемам, представленным в таблице 8.
Т а б л и ц а 8
| номер задания | Схемы ОВР |
| SiO2 + C + Cl2 →SiCl4 + CO Fe + H2O → FeO·Fe2O3 + H2 KClO3 + MnO2 + KOH → KCl + K2MnO4 + H2O | |
| Ni + H2SO4(конц.) → NiSO4 + S + H2O Ca3(PO4)2 + C + SiO2 → P + CaSiO3 + CO Fe + O2 + H2O → Fe(OH)3 (при нагревании) | |
| NH3 + O2 → N2 + H2O Na2SO4 + C → Na2S + CO (при нагревании) Al + FeO·Fe2O3 → Fe + Al2O3 | |
| Na2SO4 + SiO2 + C → Na2SiO3 + SO2 +CO2 Sn(NO3)2 → SnO + NO2 + O2 (при нагревании) N2 + CS2 → CO2 + N2 + S | |
| NH3 + O2 → NO + H2O (в присутствии Pt) MnO2 + O2 + KOH → K2MnO4 + H2O Al + HNO3(конц.) → Al(NO3)3 + N2O + H2O | |
| Pb(NO3)2 → PbO + NO2 + O2 (при нагревании) SO2 + NO2 + H2O → H2SO4 + NO Ni(CrO2)2 + Na2CO3 + O2 → Na2CrO4 + Ni2O3 + CO2 | |
| KNO3 + Fe2O3 + KOH → KNO2 + K2FeO4 + H2O Mn(OH)2 + O2 + H2O → Mn(OH)4 K2Cr2O7 + C → K2O + Cr2O3 + CO (при нагревании) | |
| Al + KNO3 + KOH → K3AlO3 + NH3 + H2O B2O3 + Cl2 + C → BCl3 + CO (при нагревании) KNO3 + KOH + Cr2O3 → KNO2 + K2CrO4 + H2O | |
| Fe + HNO3(конц.) → Fe2O3 + N2O3 + H2O NO + CS2 → CO2 + N2 + S Be + H2SO4(конц.) → BeO + SO2 + H2O | |
| Zn + HNO3(разб.) → Zn(NO3)2 + NH4NO3 + H2O Na2Cr2O7 → Na2CrO4 + Cr2O3 + O2 (при нагревании) CrO3 + NH3 → Cr2O3 + N2 + H2O | |
| Al + HNO3(конц.) → Al2O3 + NO2 + H2O NaMnO4 → Na2MnO4 + MnO2 + O2 Be + HNO3(конц.) → NO2 + Be(NO3)2 + H2O | |
| Cr2O3 + NaClO3 + NaOH → NaCl + Na2CrO4 + H2O S + HNO3(конц.) → H2SO4 + NO Mn + H2SO4(конц.) → MnSO4 + H2O + S | |
| Cr + HNO3(конц.) → Cr(NO3)3 + NO + H2O (при нагревании) SiO2 + C + Cl2 → SiCl4 + CO (при нагревании) As + HNO3(конц.) + H2O → H3AsO4 + NO | |
| MoS2 + K2CO3 + O2 → K2MoO4 + K2SO4 + CO2 Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O P + HNO3(конц.) → H3PO4 + NO2 + H2O | |
| AsH3 + HNO3(конц.) → H3AsO4 + NO + H2O C + H2SO4(конц.) → H2O + CO2 + SO2 AgNO3 → Ag + NO2 + O2 (при нагревании) | |
| SO2 + NO2 + H2O → H2SO4 + NO Cr + HNO3(конц.) → Cr2O3 + NO2 + H2O HCl + O2→Cl2 + H2O | |
| MnSO4 + NaClO3 + NaOH → NaCl + Na2MnO4 + Na2SO4 + H2O Fe + O2 + H2O → Fe(OH)3 PH3 + HNO3(конц.) → H3PO4 + NO + H2O | |
| Ni(CrO2)2 + C → Ni + Cr + CO Al + NaOH→NaAlO2 + H2 KMnO4 + K2C2O4 + H2SO4 → MnSO4 + K2SO4 + CO2 + H2O | |
| WS2 + K2CO3 + O2 → K2WO4 + K2SO4 + CO2 Zn + H2Cr2O7 + H2SO4 → ZnSO4 + Cr2O3 + H2O B + HNO3(конц.) → H3BO3 + NO2 + H2O | |
| V + H2SO4(конц.) → V2O5 + H2O + S Fe + HNO3(конц.) → Fe2O3 + NO2 + H2O S + HNO3(конц.) → H2SO4 + NO2 + H2O |
Электродные потенциалы и электродвижущие силы
Обычно Г.Э.составляется из двух разнородных металлов,погруженных в растворы одноименных с этими металлами солей. Растворы сообщаются друг с другом… Существуют Г.Э., в которых генерация постоянного электрического тока… Если внешняя цепь в Г.Э. разомкнута, то электрический ток не вырабатывается, а на каждом электроде устанавливается…Контрольные задания
141-150. Пользуясь таблицей стандартных электродных потенциалов, (см. таблицу 15) для металлов, заданных в таблице 9, и их солей, составить схему гальванического элемента.
1. Написать электронные уравнения анодного и катодного процессов, происходящих при работе гальванического элемента.
2. Рассчитать ЭДС гальванического элемента.
3. Записать суммарное уравнение ОВР.
Т а б л и ц а 9
| номер задания | Ме1 | CM(Ме1n+), М | Ме2 | CM(Ме2m+), М |
| Cd | [Cd2+] = 0,1 | Al | [Al3+] = 0,01 | |
| Ag | [Ag+] = 0,001 | Ti | [Ti2+] = 0,1 | |
| Zn | [Zn2+] = 0,01 | Mn | [Mn2+] = 0,1 | |
| Fe | [Fe2+] = 0,1 | Pb | [Pb2+] = 0,1 | |
| Ni | [Ni2+] = 0,01 | Sn | [Sn2+] = 0,01 | |
| Hg | [Hg2+] = 0,1 | Al | [Al3+] = 0,01 | |
| Cr | [Cr3+] = 0,01 | Ag | [Ag+] = 0,001 | |
| Mg | [Mg2+] = 0,1 | Au | [Au3+] = 0,001 | |
| Al | [Al3+] = 0,01 | Zn | [Zn2+] = 0,1 | |
| Cu | [Cu2+] = 0,001 | V | [V2+] = 0,01 |
151-160. Для своего варианта в таблице 10 подобрать металл в пару к заданному Me1. Концентрацию соли выбираемого металла Me2 принять равной 0,1 моль/л. Подобрав металл, составить схему Г.Э. и выполнить пункты 1-3 предыдущего задания (т.е. заданий 140-150).
Т а б л и ц а 10
| номер задания | Ме1 | CM(Ме1n+), М | подобрать в пару металл Me2, являющийся: |
| Mg | [Mg2+] = 0,01 | анодом | |
| Cu | [Cu2+] = 0,05 | катодом | |
| Ag | [Ag+] = 0,1 | катодом | |
| Hg | [Hg2+] = 0,001 | анодом | |
| Co | [Co2+] = 0,01 | катодом | |
| Sn | [Sn2+] = 0,05 | анодом | |
| Fe | [Fe2+] = 0,1 | анодом | |
| Zn | [Zn2+] = 0,01 | катодом | |
| V | [V2+] = 0,05 | анодом | |
| Al | [Al3+] = 0,1 | катодом |
Коррозия металлов
Чаще всего, используя на практике металлы и сплавы, а также при эксплуатации различного оборудования, приходится сталкиваться с электрохимической… На аноде всегда будет проходить процесс окисления металла: Ме – nē → Men+ (анодный процесс).Контрольные задания
1. Составить схему микрогальванического элемента, пометив какой металл является катодом, а какой анодом.
2. В соответствии со средой, указанной в таблице 11, составить электронные уравнения катодного и анодного процессов.
3. Составить уравнения образования конечных продуктов коррозии.
Т а б л и ц а 11
| номер задания | контактирующие металлы | коррозионная среда |
| Al и Cd | HCl | |
| Cu и Zn | Ca(OH)2 | |
| Cu и Mg | влажный воздух | |
| Zn и Pb | вода, насыщенная кислородом | |
| Ni и Cu | Н2SO4 | |
| Cr и Cu | CH3COOH | |
| Pb и Zn | влажный воздух | |
| Fe и Sn | HCl | |
| Ni и Ag | Na2CO3 (раствор) | |
| Cu и Cr | Ca(OH)2 | |
| Cd и Fe | влажный воздух | |
| Fe и Sn | HF | |
| Mg и Cu | HCl | |
| Al и Cu | вода, насыщенная кислородом | |
| Cr и Mg | Н2SO4 | |
| Ag и Cd | HСl | |
| Fe и Zn | влажный воздух | |
| Cd и Al | К2CO3 | |
| Cu и Co | HF | |
| Fe и Mg | вода, насыщенная кислородом |
Электролиз
Как и при работе гальванических элементов, электрод, на котором происходит восстановление,называется катодом, а электрод, на котором происходит… При электролизе расплавов (вода в системе отсутствует) процесс электролиза… 2Сl– – 2ē → Cl2 (анод),Контрольные задания
1. Составить электронные уравнения катодного и анодного процессов электролиза для заданного в табл. 12 раствора (или расплава) электролита:
· с нерастворимым анодом;
· с растворимым анодом (если анод указан в задании).
2. Рассчитать по закону Фарадея массу металла, выделившегося на катоде, или объем газа (при н.у.), выделившегося на аноде.
3. Составить молекулярное уравнение процесса электролиза.
Т а б л и ц а 12
| номер задания | соль | раств. анод | I, А | t, час | рассчитать: |
| CuSO4 (раствор) | Cu | m(Cu) | |||
| ScCl3 (раствор) | Sc | 1,5 | V(Cl2) | ||
| Pb(NO3)2 (раствор) | Pb | m(Pb) | |||
| TiCl4 (расплав) | Ti | V(Cl2) | |||
| SnCl2 (расплав) | Sn | 0,5 | m(Sn) | ||
| Ni2(SO4)3 (раствор) | Ni | 0,8 | V(O2) | ||
| AgNO3 (раствор) | Ag | m(Ag) | |||
| Cr(NO3)3 (раствор) | Cr | 1,5 | V(O2) | ||
| AlF3 (расплав) | – | m(Al) | |||
| CoSO4 (раствор) | Co | V(O2) |
Задания по органической химии. Полимеры
191. Какие соединения называются диеновыми? Привести пример. Написать схему полимеризации при производстве синтетического каучука.
192. Предельные и непредельные углеводороды. Написать общие формулы алканов и алкенов. Примеры. Что такое полимеризация и поликонденсация? В чем отличие способов получения этих высокомолекулярных соединений?
193. Записать структурную формулу акриловой кислоты. Составить уравнение этерификации акриловой кислоты с этиловым спиртом. Напишите схему полимеризации полученного продукта этерификации.
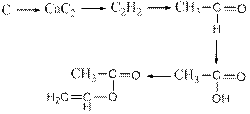
194. Составить уравнения реакций в соответствии с цепочкой превращений:
195. Напишите структурную формулу метакриловой кислоты. Составьте уравнения реакции взаимодействия этой кислоты с метанолом, а затем приведите схему полимеризации полученного продукта этерификации.
196. Приведите примеры двух простейших аминокислот. Составьте формулы двух тетрапептидов из этих аминокислот (один – из однородных мономеров; второй – из различных). Назовите полимер из однородных мономеров.
197. Что такое альдегиды? Какова общая формула этих соединений? Написать реакцию серебряного зеркала для ацетальдегида.
198. Написать формулы фенола и муравьиного альдегида. Составить схему получения фенолформальдегидной смолы.
199. Написать формулу изопрена. Составить схему получения натурального каучука.
200. Написать структурную формулу стирола. Составить схему получения полистирола.
ПРИЛОЖЕНИЯ
Т а б л и ц а 13. Номера вопросов для контрольной работы Предпоследняя цифра шифра Последняя цифра шифра … Т а б л и ц а 13. Номера вопросов для контрольной работы (окончание) Предпоследняя цифра шифра …СПИСОК РЕКОМЕНДОВАННОЙ ЛИТЕРАТУРЫ
О С Н О В Н А Я 1. Глинка Н.Л. Общая химия. – М., КноРус, 2009.– Конец работы –
Используемые теги: Химия, изучению, дисциплины, задания, контрольных, работ0.092
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ХИМИЯ По изучению дисциплины и задания для контрольных работ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов