Электролиз
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического токачерез систему, состоящую из раствора или расплава электролита и из двух электродов, помещенных в раствор или расплав.
Как и при работе гальванических элементов, электрод, на котором происходит восстановление,называется катодом, а электрод, на котором происходит окисление – анодом.
При электролизе расплавов (вода в системе отсутствует) процесс электролиза протекает по относительно простому механизму. На катоде идет процесс восстановления катиона электролита, а на аноде – процесс окисления аниона электролита, например, электролиз расплава ScCl3:
2Сl– – 2ē → Cl2 (анод),
Sc3+ + 3ē → Sc (катод).
В случае электролиза водных растворов электролитов на механизм химических превращений при электролизе накладывается возможное превращение воды под воздействием постоянного электрического тока.
Принято отдельно рассматривать процессы, протекающие на катоде (т.е. процессы восстановления). Эти процессы не зависят от материала катода, а определяются преимущественно положением металла электролита в ряду стандартных электродных потенциалов. Богатейший индустриальный и научный опыт показывает, что, если металл, образующий данный электролит, находится в ряду стандартных электродных потенциалов после водорода (т.е. Eº > 0), то из двух конкурирующих процессов (восстановление молекул Н2О или восстановление катионов Меn+) предпочтение получают катионы Меn+, т.к. потенциал у этих катионов значительно больше, чем потенциал восстановления воды. Такие металлы называются малоактивными. В этом случае полуреакции восстановления выглядят так:
(катод) Меn+ + nē → Me.
При движении по ряду напряжений справа налево, наблюдаем уже сопоставимые величины стандартных электродных потенциалов. Поэтому, на катоде одновременно идут два процесса – восстановление H2O и восстановление Меn+. Такие металлы образуют группу металлов средней активности. Условно считается, что в эту группу входят металлы от алюминия до водорода в ряду напряжений металлов. Катодный процесс записывают двумя электронными уравнениями:
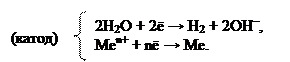
Для катионов металлов, находящихся левее алюминия (а также сам алюминий), величины стандартных электродных потенциалов уже значительно ниже, чем потенциал восстановления воды. Поэтому на катоде будет проходить единственный процесс – восстановление воды. Такие металлы называются активными. На катоде происходит следующий процесс:
(катод) 2Н2О +2ē → Н2 + 2ОН–.
Процессы, проходящие на аноде, зависят от материала, из которого изготовлен анод. Инертным (нерастворимым) называется анод, изготовленный из графита, золота, рутения, родия, палладия, осмия, иридия или платины. Аноды, изготовленные из других металлов, называются растворимыми.
Если анод нерастворимый и анион в составе соли не содержит кислород (например S2–, Cl–, Se2–, Br–, и т.п.), то при достаточно больших концентрациях этих анионов они легко окисляются (исключением из этого правила является анион F–). В этом случае анодный процесс записывается следующим образом:
(анод) S2– – 2ē → S (пример для сульфидного аниона),
(анод) 2Br– – 2ē → Br2 (пример для бромидного аниона).
Если же анод нерастворимый, а в составе аниона соли содержится кислород(например, NO3–, SO42–, и т.п.), то окисляется вода. Такое же правило действует для фторидных анионов F–. На аноде проходит следующий процесс:
(анод) 2Н2О – 4ē → О2 + 4Н+.
Если анод растворимый, то происходит растворение металла, из которого изготовлен анод:
(анод) Me – nē → Меn+.
Для того чтобы рассчитать количественные характеристики процесса электролиза, можно воспользоваться законами Фарадея.
Согласно II закону Фарадея, масса электролита, подвергшаяся разложению при электролизе, а также массы, образующихся на электродах веществ прямо пропорциональны количеству электричества(в кулонах), прошедшего через раствор (или расплав) электролита, и эквивалентным массам соответствующих веществ:
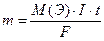 ,
,
где m – масса электролита, окисленного или восстановленного на электроде;
М(Э) – молярная масса эквивалента электролита, измеряется в г/моль-экв.;
I – сила тока, А;
t – продолжительность электролиза, с;
F – число Фарадея. F ≈ 96500 Кл/моль.
Для нахождения молярной массы эквивалента электролита, следует разделить молярную массу электролита на число электронов, участвующих в реакции.