Основные законы химии
1. Закон сохранения массы вещества Масса веществ, вступающих в химическую реакцию равна массе веществ, образующихся в результате реакции.
2. Закон постоянства состава вещества Всякое химически чистое вещество молекулярной структуры всегда имеет постоянный качественный и количественный состав независимо от условий и способа получения этого вещества. Состав же соединений немолекулярной структуры (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
3. Закон Авогадро В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Из закона Авогадро вытекает важное следствие: при одинаковых условиях 1 моль любого газа занимает одинаковый объем. При нормальных условиях (0ºС и р=101,3 кПа) 1 моль различных газов занимает объем, равный 22,4 л. Этот объем называется молярным объемом газа.
4. Закон эквивалентов Вещества, вступающие в химические реакции, реагируют между собой в количествах, прямо пропорциональных массам их эквивалентов.
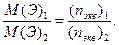
М(Э)1 и М(Э)2 – молярные массы эквивалентов веществ (1) и (2) соответственно.
n(экв)1 и n(экв)2 – числа моль эквивалентов веществ (1) и (2) соответственно. Как вычисляют М(Э)1 и М(Э)2, следует смотреть в учебнике.