Химическая кинетика и химическое равновесие
Химическая кинетика – раздел химии, изучающий закономерности протекания химических реакций во времени, а также механизмы химических превращений. Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени.
Скорость химической реакции в каждый момент времени выражается пропорциональна концентрациям реагентов, возведённым в некоторые степени (закон действующих масс).
Пример 1.Во сколько раз изменится скорость прямой и обратной реакций в равновесной системе
2SO2(г.) + O2(г.) ↔ 2SO3(г.),
при увеличении давления в 2 раза?
Обозначим исходные равновесные концентрации реагирующих веществ квадратными скобками [SO2], [O2], [SO3].
По закону действующих масс скорости прямой и обратной реакции до увеличения давления в системе были:
Vпр. = kпр.[SO2]2[O2],
Vобр. = kобр.[SO3]2.
Увеличение давления приводит к пропорциональному уменьшению объема системы, и соответственно, увеличению концентрации газообразных веществ в системе. Таким образом, двукратное увеличение давления в системе приводит к двукратному же увеличению концентраций. Очевидно, что скорости как прямого, так и обратного процессов увеличатся. Если записать скорости реакции после увеличения давления, выражая концентрации веществ через исходные, получим следующие выражения:
V’пр. = kпр.(2[SO2])2(2[O2]) = kпр.22[SO2]2·2[O2] =
= 8·kпр.[SO2]2[O2] = 8·Vпр.,
V’обр. = kобр.(2[SO3])2 = kобр.22[SO3]2 =
= 4·kобр.[SO3]2 = 4·Vобр..
Таким образом, скорость прямой реакции увеличилась в 8 раз, а скорость обратной – в 4 раза.
Пример 2.Рассчитать, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если температуру понизить от 80ºC до 50ºC. Температурный коэффициент скорости реакции равен 3.
Зависимость скорости реакции от температуры определяется приближенным (эмпирическим) правилом Вант-Гоффа:
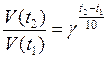 ,
,
где t1 – начальная температура,
t2 – конечная температура,
γ – температурный коэффициент скорости реакции.
Подставляя заданные значения, получаем:
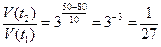 .
.
Таким образом, скорость реакции при охлаждении от 80ºC до 50ºC уменьшается в 27 раз.