Константа равновесия
Химическое равновесие – это состояние химической системы, при котором скорости прямой и обратной реакций равны и не изменяются во времени.
Состав реакционной смеси, соответствующий состоянию равновесия, называется равновесным составом,а концентрации веществ, находящихся в равновесии, называются равновесными концентрациями.Равновесный состав зависит от природы веществ, участвующих в равновесии, от соотношения количеств исходных веществ, а также от внешних условий (температуры, давления). При изменении любого из этих факторов равновесный состав изменяется — равновесие смещается.
Количественной характеристикой системы в состоянии химического равновесия является константа равновесия K.
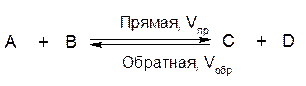
Важно понимать, что константа равновесия выражается через равновесные концентрации, но не зависит от них
Константа равновесия зависит от природы реагирующих веществ и температуры и представляет собой постоянную (при постоянной температуре) величину.
12 вопрос: Смещение химического равновесия. Принцип Ле Шателье. Основныепричины смещения химического равновесия.
Система, находящаяся в состоянии химического равновесия, будет пребывать в нём до тех пор, пока внешние условия остаются постоянными.
Принцип Ле Шателье: – если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию веществ), то равновесие сместиться в сторону протекания той реакции, которая ослабляет это воздействие.
Рассмотрим 3 случая нарушения равновесия.
1 Изменение концентрации какого-либо из исходных веществ, участвующих в реакции (температура и давление постоянны):
Увеличение концентрации одного из реагирующих веществ путем ввода в систему дополнительного количества этого вещества смещает равновесие в сторону прямой реакции (т. е. расходования части дополнительно введенного вещества).
Повышение концентрации одного из продуктов реакции смещает равновесие в сторону обратной реакции (по той же причине).
Уменьшение концентрации одного из исходных веществ ведет к смещению равновесия в сторону обратной реакции.
Уменьшение концентрации одного из продуктов - к смещению равновесия в сторону прямой реакции.
2. Нарушение равновесия вследствие изменения давления (путем уменьшения или увеличения объема, температура постоянна)
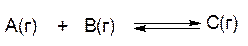
Отсюда вывод: при увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газа, т.е. в сторону понижения давления; при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул, т.е. в сторону увеличения давления.