Ионное произведение воды. Водородный показатель
Вода — очень слабый электролит, диссоциирующий по схеме:
Н2О « Н+ + ОН- (или более строго 2Н2О « Н3О+ + ОН-)
Выражение для константы диссоциации воды:
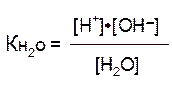
можно представить в другой форме:
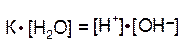
Так как диссоциирована лишь ничтожная доля молекул воды, то равновесную концентрацию недиссоциированных молекул, равную 55,5 моль/л, можно считать постоянной. Произведение двух постоянных величин K[Н2О] можно представить в виде одной константы:
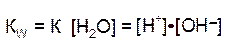
Константа Кw, равная произведению концентраций ионов Н+ и ОН-, величина постоянная при данной температуре, получила название ионное произведение воды.
Постоянство Кw, требует, чтобы изменение концентрации одного из ионов, на которые диссоциирует вода, компенсировалось изменением концентрации другого иона в противоположную сторону. На основании этого, зная концентрацию ионов Н+ в каком-то растворе, легко вычислить концентрацию ионов ОН- и, наоборот, зная концентрацию ионов ОН-, легко вычислить концентрацию Н+:
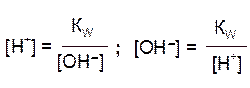
Отсюда следует, что для характеристики кислотности раствора (кислый, нейтральный, щелочной) достаточно указать концентрацию ионов водорода. В чистой воде при 25°С концентрации ионов водорода и гидроксид-ионов равны и составляют:
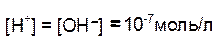
Растворы, в которых концентрации ионов водорода и гидроксид-ионов равны, называются нейтральными. В кислыхрастворах концентрация ионов Н+ выше, чем ионов ОН-, а в щелочных- концентрация ионов Н+ ниже концентрации ОН-. Поскольку концентрация ионов водорода выражается числом 10 в отрицательной степени и оперировать такой малой величиной неудобно, то для характеристики кислотности растворов был введен водородный показатель рН,представляющий собой десятичный логарифм концентрации ионов водорода с обратным знаком:
рН = - lg[H+]
Очевидно, что для чистой воды при комнатной температуре рН = 7. В кислой среде рН < 7, а в щелочной рН > 7. Зная водородный показатель, легко определить при необходимости и гидроксильный показатель рОН. Если КW = [Н+][ОН-] = 10-14, то
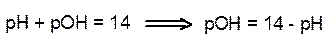
Способы определения рН раствора
Значение рН растворов можно определять с помощью специальных приборов. Для приблизительного определения рН служат кислотно-основные индикаторы,которые представляют собой слабые органические кислоты (фенолфталеин) или основания (метилоранж). Действие кислотно-основных индикаторов основано на том, что диссоциированная и недиссоциированная формы индикатора имеют разную окраску. Например, фенолфталеин в недиссоциированной форме НАс - бесцветный, а в анионной форме Ас- - малиновый.
В зависимости от окраски молекулярной и ионной форм индикаторы могут быть двухцветными (имеют окраску обе формы), например метилоранж, лакмус, или одноцветными (одна из форм бесцветна), например фенолфталеин.
Если индикатор представляет собой органическую кислоту, он диссоциирует по схеме:
НАс ↔ Н+ + Ас-
где Ас - кислотный остаток этой кислоты.
При высокой концентрации ионов водорода, т. е. в кислой среде, равновесие диссоциации индикатора смещено влево, т. е. его диссоциация подавляется, причем в тем большей степени, чем меньше сила кислоты, являющейся индикатором.
Для каждого индикатора существует определенный интервал изменения окраски,в этом интервале концентрации ионизованной и неионизованной форм соизмеримы и окраска индикатора меняется в зависимости от рН раствора. За пределами этого интервала окраска индикатора остается практически постоянной вне зависимости от рН раствора.
Если рН исследуемого раствора оказывается за пределами интервала, в котором данный индикатор меняет окраску, то этот индикатор может лишь показать, что рН больше или меньше какого-то значения. В этом случае для определения рН следует использовать другие индикаторы, с другим интервалом изменения окраски, постепенно сужая, таким образом, интервал, в котором может быть рН исследуемого раствора.
Существуют универсальные индикаторы,представляющие собой смесь нескольких индикаторов, каждый из которых меняет цвет в своей области рН, поэтому цвет универсального индикатора в целом изменяется в гораздо большем интервале рН. Индикаторы позволяют определять рН с точностью до нескольких десятых долей единицы.
18 вопрос: Гидролиз солей. Степень гидролиза. Константа гидролиза
Гидролиз –это разложение какого-либо вещества под действием воды.
Гидролиз соли представляет собой реакцию, обратную реакции нейтрализации. Так, если гидролизуется соль, состоящая из катиона А и аниона В (для простоты примем их однозарядными), то имеет место обратимая реакция:
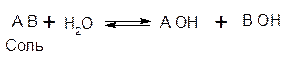
Чтобы гидролиз протекал необходимо, чтобы образовывался осадок. Возможны, 3 варианта гидролиза:
–соль должна быть образована слабой кислотой и сильным основанием;
– соль должна быть образована слабым основанием и сильной кислотой;
– соль должна быть образована слабым основанием и слабой кислотой.