Реакции, при которых изменяются степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Это реакции замещения, а также некоторые реакции соединения и разложения
Окислительно-восстановительная реакция — это единый процесс, состоящий из двух разных полуреакций: полуреакции окисления и полуреакции восстановления, которые идут одновременно.
Окисление - это процесс потери электронов атомом, молекулой или ионом.
Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.
Окислителем называется вещество, атомы, молекулы или ионы которого присоединяют электроны:
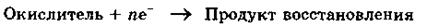 |
Окислитель восстанавливается в процессе восстановления. Восстановителем называется вещество, атомы, молекулы или ионы которого отдают электроны:
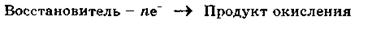 |
Восстановитель окисляется в процессе окисления.
Так как электрон заряжен отрицательно, то при окислении степень окисления (окислительное число) атома изменяется в положительную сторону, а при восстановлении — в отрицательную.
Cтепень окисления –это условный заряд атома в соединении, вычисленный исходя из предположения, что данный атом связан с другими ионной связью.
20 вопрос: Типы ОВР. Типичные окислители и восстановители.
Типы ОВР:
1. МежмолекулярныеОВР - это реакции, которые идут с изменением степени окисления атомов в молекулах разных веществ:
 |
ОВР такого типа встречаются чаще всего.
2. ВнутримолекулярныеОВР - это реакции, которые идут с изменением степени окисления разных атомов в одной молекуле. При этом атом элемента с более высокой степенью окисления является окислителем и окисляет атом элемента с меньшей степенью окисления.
Например:
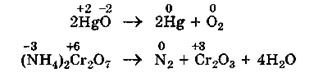 |
3.Реакции диспропорционирования(дисмутации) - это реакции, которые идут с изменением степени окисления одинаковых атомов в молекуле (или молекулах) одного и того же вещества.
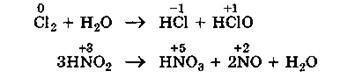 |
4.Реакции конпропорционирования(конмутации) — это реакции, обратные реакциям диспропорционирования. В результате этих реакций атомы одного элемента, находящиеся в разных степенях окисления, переходят к общей степени окисления, промежуточной между исходными степенями.
Реакции конпропорционирования могут быть как:
─ межмолекулярными
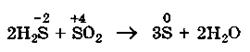 |
─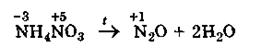 так и внутримолекулярными
так и внутримолекулярными
Реакции диспропорционирования и конпропорционирования иногда объединяют общим названием реакции самоокисления-самовосстановления.
В качестве типичных окислителей могут выступать:
1) простые вещества, образуемые атомами с большой электроотрицательностью, т. е. типичные неметаллы, расположенные, прежде всего, в главных подгруппах шестой и седьмой групп периодической системы;
2) вещества, содержащие элементы в высших и промежуточных положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fе3+), так и кислородсодержащих, оксоанионов (перманганат-ион);
3) перекисные соединения (пероксиды, супероксиды и т. д.);
4) Кислородсодержащие анионы, содержащие атом неметалла в высшей положительной степени окисления (SO4 (степень окисления серы +6), NO3 (степень окисления азота +5)
В качестве типичных восстановителей могут выступать:
1) простые вещества, атомы которых имеют низкую электроотрицательность («активные» металлы);
2) катионы металлов в низших степенях окисления (Fе2+);
3) простые, элементарные анионы, например сульфид-ион;
4) кислородсодержащие анионы (оксоанионы), соответствующие низшим положительным степеням окисления элемента (нитрит, сульфит);
5) катод электролизной ячейки.
21вопрос: Составление уравнений ОВР(м-д электронного баланса,м-д полуреакций)
Метод электронного баланса (окислительных чисел) рассмотрим на примере реакции
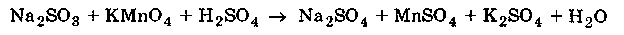
Для расстановки коэффициентов выполняем следующие действия.
1. Определяем элементы, атомы которых изменяют степень окисления:
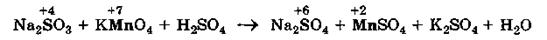 |
2. Находим окислитель и восстановитель в данной ОВР и пишем отдельно электронные уравнения процессов окисления и восстановления:
3. Уравниваем число электронов в процессе окисления и восстановления (электронный баланс):
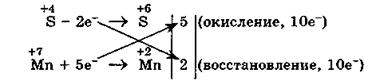 |
4. Коэффициенты 5 и 2 из электронных уравнений переносим в молекулярное уравнение ОВР:
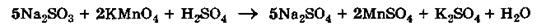 |
5. Окончательно уравниваем число атомов каждого элемента в обеих частях молекулярного уравнения:
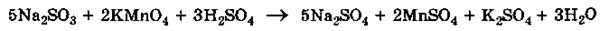
Mетод полуреакций (ионно-молекулярный метод) основан на составлении уравнений процессов окисления и восстановления с помощью ионов и молекул, реально существующих в растворе. Сильные электролиты записывают в виде ионов, а слабые электролиты, газы и малорастворимые вещества - в виде молекул.

Теперь уравниваем число электронов в полуреакциях окисления и восстановления и получаем» сокращенное ионно молекулярное уравнение ОВР:Записываем молекулярное уравнение ОВР:
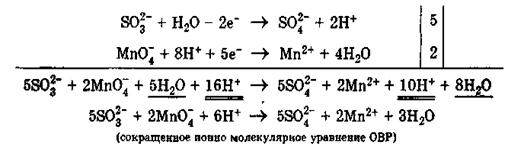 |