Основы номенклатуры в органической химии
Чтобы ориентироваться в мире органических соединений, необходимо не только знать принципы их классификации, но и уметь правильно назвать каждое из них. При этом должно быть соблюдено важное правило: каждому названию должно соответствовать только одно соединение.
Правила, по которым образуются названия органических соединений, составляют номенклатуру. В настоящее время в органической химии применяют несколько систем номенклатуры.
1. Тривиальная номенклатура
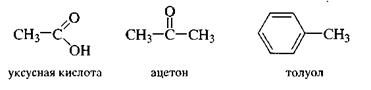 Это система исторически сложившихся названий, но применяемых до настоящего времени. Как правило, эти названия были даны еще в ранний период развития органической химии и никак не отражают строение органического вещества.
Это система исторически сложившихся названий, но применяемых до настоящего времени. Как правило, эти названия были даны еще в ранний период развития органической химии и никак не отражают строение органического вещества.
2.Рациональная номенклатура. По правилам рациональной номенклатуры за основу названия органического соединения принимают название наиболее простого (чаще первого) члена данного гомологического ряда. Все остальные соединения рассматривают как его производные, образованные замещением в нем атомов водорода алкильными группами, атомами или функциональными группами. Названия алкильных и функциональных групп, наиболее часто встречающихся в структурных формулах органических молекул, и примеры названий по рациональной номенклатуре приведены в табл. 1.2 и 1.3.
3. Систематическая номенклатура ИЮПАК (Международный союз теоретической и прикладной химии). Является наиболее общепринятой и универсальной. Систематические названия составлены из слов, специально созданных или выбранных для описания структурных особенностей соединения.
Для того чтобы назвать органическое соединение по систематической номенклатуре ИЮПАК, нужно:
1) выбрать родоначальную структуру;
2) выявить все имеющиеся в соединении функциональные группы;
3) установить, какая группа является старшей (см. табл. 1.4);
название этой группы отражается в названии соединения в виде суффикса и его ставят в конце названия соединения; все остальные группы дают в названии в виде префиксов (приставок);
4) обозначить ненасыщенность соответствующим суффиксом (-ен или -ин), а также префиксом (дегидро-, тетрагидро- и др.);
5) пронумеровать главную цепь, придавая старшей группе наименьший из номеров;
6) перечислить префиксы (приставки) в алфавитном порядке (при этом умножающие префиксы ди-, три- и т. д. не учитываются);
7) составить полное название соединения.
Родоначальная структура - главная цепь в ациклической молекуле; циклическая или гетероциклическая система (или ее часть), лежащая в основе соединения.
В ациклических соединениях главной цепью называют цепь углеродных атомов, составляющую основу названия и нумерации. В состав этой цепи обязательно должна входить старшая характеристическая группа. Главная цепь должна содержать наибольшее число заместителей, максимальное количество кратных (двойных и тройных) связей и должна быть наиболее длинной. Главную цепь нумеруют в соответствии с наименьшей суммой цифровых индексов, указывающих положения заместителей и кратных связей. Наименьшая сумма цифровых индексов - это ряд чисел, в котором первое отличающееся число должно быть наименьшим.
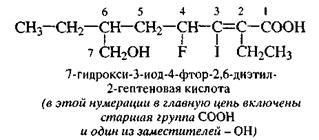 |
В случае кратных связей при одинаковых цифровых индексах двойных и тройных связей предпочтение отдается двойной связи.
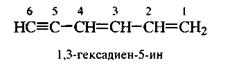 |
В алициклических соединениях главной цепью считают замкнутую цепь углеродных атомов. В названии этой цепи применяют префикс цикла-.
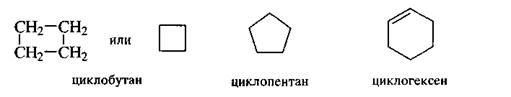 |
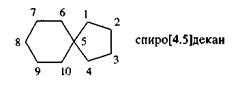 Углеводороды, содержащие два цикла, у которых один атом углерода -общий, имеют в названии префикс спиро-.
Углеводороды, содержащие два цикла, у которых один атом углерода -общий, имеют в названии префикс спиро-.
Цифры в квадратных скобках указывают, сколько углеродных атомов находится по каждую сторону от общего (узлового) атома углерода.
Если в соединениях два цикла имеют два или больше общих углеродных атомов, то их называют бициклоалканами (или мастиковыми углеводородами).
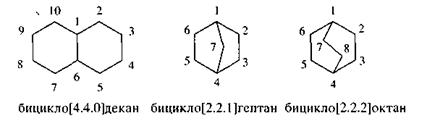 |
В квадратных скобках цифрами указывают число атомов углерода в мостиках, соединяющих узловые углеродные атомы циклов.
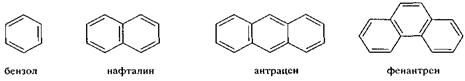 В основе названий ароматических углеводородов лежат тривиальные названия.
В основе названий ароматических углеводородов лежат тривиальные названия.
В гетероциклических соединениях за основу берут название соответствующего гетероцикла.
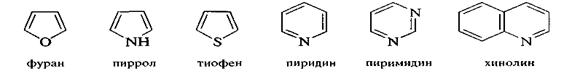 |
При выборе старшей группы важно старшинство заместителей относительно друг друга. Функциональные группы в порядке убывания старшинства перечислены в табл. 1.4. Там же указано, какое название получает функциональная группа в зависимости от ее места (в виде префикса или суффикса) в полном названии соединения.
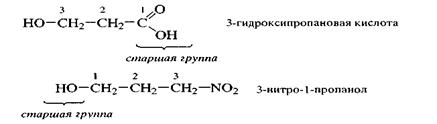 |
После того как определена родоначальная структура, выбрана старшая группа (обозначается суффиксом), проведена нумерация, выявлены другие
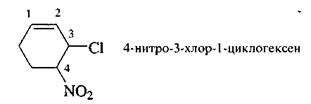 группы, составляют полное название. При этом цифровые индексы (локанты), указывающие положение заместителей и кратных связей, дают перед префиксом и перед суффиксом.
группы, составляют полное название. При этом цифровые индексы (локанты), указывающие положение заместителей и кратных связей, дают перед префиксом и перед суффиксом.
4. Радикало-функциональная номенклатураЭта система использует те же приемы, что и рациональная, но не содержит суффиксов. По этой номенклатуре роль суффикса играет название класса соединения.
 |
24 вопрос
1 Общая характеристика: строение, классификация, номенклатура
Алканы– наиболее простой по элементному составу класс органических соединений. Они состоят из углерода и водорода. Родоначальником этого класса является метан СН4. Все остальные углеводороды, относящиеся к алканам, являются членами гомологического ряда метана.
| Число изомеров | ||||||
| СН4 | – | метан | ||||
| С2Н6 | – | этан | ||||
| С3Н8 | – | пропан | ||||
| С4Н10 | – | бутан | ||||
| С5Н12 | – | пентан | ||||
| С6Н14 | – | гексан | Общая формула будет иметь вид: СnН2n+2 | |||
| С7Н16 | – | гептан | ||||
| С8Н18 | – | октан | ||||
| С9Н20 | – | нонан | ||||
| С10Н22 | – | декан | ||||
| С11Н24 | – | ундекан | ||||
| С12Н26 | – | додекан | ||||
| С13Н28 | – | тридекан | ||||
| С14Н30 | – | тетрадекан | 1 858 | |||
| С15Н32 | – | пентадекан | 4 347 | |||
| С20Н42 | – | эйкозан | 366 319 |
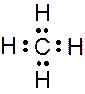
Углерод имеет на внешней оболочке четыре валентных электрона, поэтому он может образовывать с атомами водорода четыре двухэлектронные ковалентные связи:
 или
или 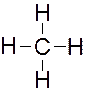
Как уже говорилось, атом углерода образовал ковалентные связи за счёт одного s-электрона и трех р-электронов, а атом водорода – за счёт единственного s-электрона. Судя по числу s- и р-электронов, должны быть три s-р связи и одна s-s. Однако физические и химические данные указывают на равноценность всех четырех связей С–Н в метане. Действительно, в метане s- и р-орбитали образуют четыре одинаковые смешанные или гибридные орбитали. Подобную гибридизацию мы назвали sр3-гибридизацией. Углы между связями 109о28' – тетра-эдрические.
Связь С–Н в метане может разрываться тремя различными способами:
1) электронная пара остается у атома углерода, углерод приобретает отрицательный заряд и образуется анион: Н3С:– – карбанион;
2) электронная пара переходит к водороду, углерод заряжается положительно и возникает катион: Н3С+ – карбкатион;
3) связь разрывается так, что один электрон остается у углерода, а другой – у водорода. Это приводит к появлению двух незаряженных частиц, несущих по одному неспаренному электрону: метильному радикалу Н3С• (Н3С-) и радикалу (атому) водорода Н• (Н-). Такие частицы называются свободными радикалами. В общем случае при разрыве одной связи С–Н в алканах образуется один, а при разрыве связи С–С – два одновалентных углеводородных радикала, которые называются алкилами. Ниже приводятся названия некоторых одновалентных, насыщенных радикалов нормального строения:
| СН3• | метил |
| С2Н5• | этил |
| С3Н7• | пропил |
| С4Н9• | бутил |
| С5Н11• | пентил (амил) |
| С6Н13• | гексил |
От метана также можно произвести двухвалентный радикал метилен Н2С<и трехвалентный НС≡ – метин.
Таким образом, этан может образовать в результате объединения двух метильных радикалов
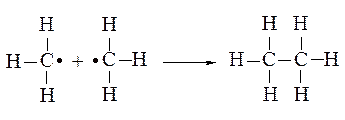
Заменяя водород в этане на метильный радикал СН3•, получаем пропан. Образовывая таким же образом следующий алкан – бутан – можно заметить, что если на метильную группу заменить водород у крайнего углерода – получим бутан с неразветвленной, или нормальной цепью атомов углерода или, как говорят, с «нормальным скелетом». Если заменяется водород метиленовой группы, то цепь разветвится и получится углеводород того же состава – изобутан – изомерный н-бутану, и отличающийся от него по своим свойствам.
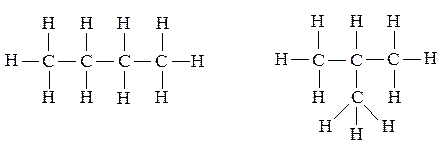
Пентан имеет уже три изомера.
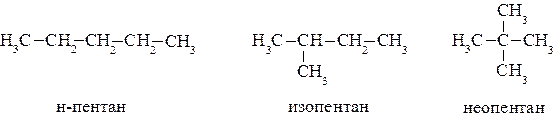
При переходе к высшим гомологам число изомеров резко возрастает (смотри выше).
Углеродный атом, связанный с одним соседним углеродным атомом, называется первичным, с двумя – вторичным, с тремя – третичным и с четырьмя – четвертичным:
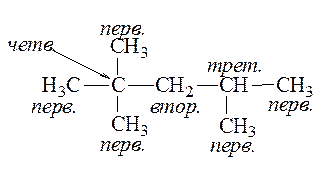
Органическая химия с миллионами соединений требует точной и ясной номенклатуры (системы названий), так чтобы по названию соединения можно было написать его структурную формулу и наоборот. Для названий алканов может использоваться несколько номенклатур:
- Историческая или тривиальная номенклатура –это сводка исторически устоявшихся названий наиболее простых и часто употребимых органических соединений. Поскольку углеродные структуры алканов лежат в основе соединений остальных классов органических соединений их названия следует запомнить. Тривиальные названия наиболее простых нормальных алканов приведены в начале раздела.
- Рациональная номенклатура.При составлении названия по этой номенклатуре соединение рассматривается как полученное из самого простого представителя ряда в результате замещения в нем водородных атомов на алкильные радикалы. Вначале называются радикалы, начиная с меньших, а затем основа. Основа выбирается из условия получения радикалов наименьшего размера.
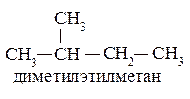
- Номенклатура IUPAC (ИЮПАК – Международный союз теоретической и прикладной химии). Первые правила приняты в 1892 г., последняя их редакция – в 1979 г.
Для наименования разветвленных углеводородов нужно выбрать наиболее длинную углеродную цепь, назвав нормальный углеводород. Ответвления рассматриваются как замещающие радикалы и их названия ставятся перед названием нормального углеводорода-основы по алфавиту. Положение замещающих радикалов в главной цепи обозначают, пронумеровав её углеродные атомы, начиная с конца, более близкого к разветвлению, и указывая номера углеродов основной цепи, с которыми эти радикалы связаны, перед их названием. Номера проставляются для каждого заместителя без исключения. Названия одинаковых алкильных заместителей объединяются с использованием умножающих приставок (диэтил-, триметил- …). Следует также помнить, что алкильные радикалы, начиная с пропильных, представлены совокупностями их изомеров, которые имеют тривиальные названия, используемые в различных номенклатурах. Следует запомнить названия и строение следующих алкильных радикалов:
Приставки «изо» и «нео» являются неотделяемыми и участвуют при расстановке названий радикалов по алфавиту, приставки «втор-» и «трет-» – отделяемые и в алфавитном порядке не участвуют.
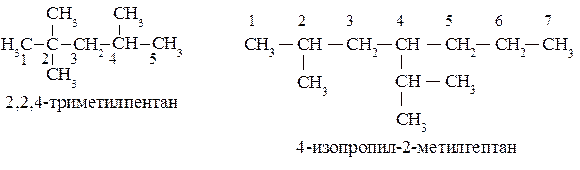
Для характеристики строения и свойств алканов важное значение имеет вопрос об их пространственной строении, о расположении атомов углерода и водорода в пространстве. Как уже говорилось, в метане атом углерода связан с четырьмя атомами водорода, которые располагаются в пространстве симметрично относительно углерода. При этом направления от атома углерода к водородным атомам идут по осям правильного тетраэдра.
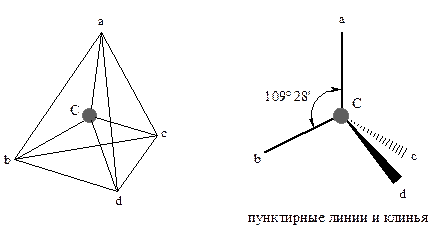
Углы между связями составляют 109° 28'. Если углерод удерживает разные атомы, углы между связями меняются, но несущественно. Максимальное перекрывание sp3-гибридных орбиталей происходит при тетраэдрическом расположении. Из рентгеноструктурных данных известно, что центры атомов углерода в алканах удалены друг от друга на 0.154 нм, а центры атомов углерода и водорода – на 0.109 нм.