Й уровень
91-95. Рассчитайте стандартный тепловой эффект реакции, предварительно подобрав коэффициенты в уравнении, и установите, является ли реакция экзо- или эндотермической. Стандартные энтальпии образования реагентов А, В и продуктов С и D взять из прил.3:
Задачи Реакции
A B C D
 91 CuCl2(т) + H2O(г) CuO(т) + HCl(г)
91 CuCl2(т) + H2O(г) CuO(т) + HCl(г)
 92 Al2(SO4)3(т) Al2O3(т) + SO3(г)
92 Al2(SO4)3(т) Al2O3(т) + SO3(г)
 93 CS2(ж) + O2(г) CO2(г) + SO2(г)
93 CS2(ж) + O2(г) CO2(г) + SO2(г)
 94 HF(г) +N2(г) NF3(г) + H2(г)
94 HF(г) +N2(г) NF3(г) + H2(г)
 95 Na2SO3(т) Na2SO4(т) + Na2S(т)
95 Na2SO3(т) Na2SO4(т) + Na2S(т)
96-100 По термохимическому уравнению взаимодействия реагентов А и В, рассчитайте стандартную энтальпию образования продукта D. Известны (прил. 3) стандартный тепловой эффект химической реакции  Н°х.р. и стандартные энтальпии образования реагентов
Н°х.р. и стандартные энтальпии образования реагентов  :
:
| Задачи | Реакции | |||||
| А | В | С | D | 
| ||
 96 96
| Na2O(т) | + SO3(т) | + H2O(ж) | NaHSO4(т) | -650 | |
 97 97
| Na2O(т) | + SO2(г) | + S(т) | Na2 S2O3(т) | -402 | |
 98 98
| CuO(т) | + NO2(г) | + O2(г) | Cu(NO3)2(т) | -440 | |
 99 99
| H2O(г) | + CO2(г) | + CuO(т) | Cu2(OH)2CO3(т) | -101 | |
 100 100
| MgO(т) | + NO2(г) | + O2(г) | Mg(NO3)2(т) | -510 |
101-105. По термохимическому уравнению рассчитайте стандартную энтальпию образования реагента А, если известны стандартные энтальпии образования веществ В, С и D (прил. 3).
ЗадачиРеакции
A B C D 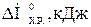
 101 KClO4(т) KClO3(т) + KCl(т) + O2(г) +60
101 KClO4(т) KClO3(т) + KCl(т) + O2(г) +60
 102 Mg(NO3)2(т) MgO(т) + NO2(г) + O2(г) +510
102 Mg(NO3)2(т) MgO(т) + NO2(г) + O2(г) +510
 103 Na2CO3×10H2O(т) NaOH(т) + CO2(г) + H2O(г) +662
103 Na2CO3×10H2O(т) NaOH(т) + CO2(г) + H2O(г) +662
 104 KH2PO4(т) KOH(т) +P4O10(т) + H2O(ж) +1020
104 KH2PO4(т) KOH(т) +P4O10(т) + H2O(ж) +1020
 105 NaHCO3(т) Na2O(т) +CO2(г) + H2O(ж) +338
105 NaHCO3(т) Na2O(т) +CO2(г) + H2O(ж) +338
106-110. Рассчитайте стандартное изменение энтропии реакции, предварительно подобрав коэффициенты в уравнении, и установите, будет ли она протекать самопроизвольно в изолированной системе при стандартных условиях. Необходимые данные взять из прил. 3:
Задачи Реакции
106NiO(т)+Al(т)=Ni(т)+Al2O3(т)
107V(т) +CaO(т) =V2O5(т) +Ca(т)
108SO2(г) +H2S(г) =S(т) +H2O(ж)
109N2H4(г) +O2(г) =N2(г) +H2O(г)
110PbS(т) +O2(г) =PbO(т) +SO2(г)
111-115. Рассчитайте при температуре 25оС стандартное изменение свободной энергии Гиббса образования оксида из соответствующих простых веществ, если известны стандартные энтальпии образования ( ,кДж/моль) и стандартные энтропии образования(Δ
,кДж/моль) и стандартные энтропии образования(Δ ,Дж/(моль·К)) данного оксида. Может ли данная реакция протекать самопроизвольно?
,Дж/(моль·К)) данного оксида. Может ли данная реакция протекать самопроизвольно?
| Задачи | |||||
| Оксид | Fе2О3 | РbО2 | ZnО | Аl2О3 | ВаО |

| -824 | -277 | -581 | -1675 | -538 |
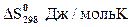 ,ДЖ/мольК ,ДЖ/мольК
|
116-120. По приведенным стандартным значениям изменения энтальпии и энтропии для химической реакции рассчитайте температуру, при которой равновероятны прямое и обратное направления данной реакции. В каком направлении, прямом или обратном, данная реакция будет протекать самопроизвольно при более высоких температурах?
| Задачи | Реакция | 
| 
|
| СО2(г)+С(г)=2СО(г) | + 173 | +176 | |
| N2(г)+3Н2(г)=2NH3(г) | -92 | -201 | |
| 2NO(г)+О2(г)=2NO2(г) | -116 | -147 | |
| SО2(г)+Сl2(г)=SС12О2(г) | -67 | -159 | |
| Сl2(г)+5F2(г)=2СlF5(г) | -478 | -616 |